Antipyretiká pre deti predpisuje pediater. Pri horúčke však existujú núdzové situácie, keď je potrebné dieťaťu okamžite podať liek. Vtedy rodičia preberajú zodpovednosť a užívajú antipyretické lieky. Čo je dovolené podávať dojčatám? Ako môžete znížiť teplotu u starších detí? Aké lieky sú najbezpečnejšie?
TNF-α (tumor necrosis factor alpha) hrá kľúčovú úlohu pri naštartovaní a udržiavaní zápalový proces pri reumatoidnej artritíde (RA). Potlačenie aktivity TNF vedie k zníženiu syntézy zápalových mediátorov v tele, vďaka čomu je potrebné terapeutický účinok pri liečbe choroby.
Jednou z nevýhod terapie inhibítormi TNF-a je vysoká cena. Tento spôsob liečby má však aj významné výhody: preukázaná účinnosť; bezpečnosť; pretrvávanie dosiahnutej remisie.
Zvážte použitie inhibítorov TNF-a v klinickej praxi na príklade lieku hojne používaného za posledných 10 rokov v USA, Kanade a európskych krajinách s názvom etanercept. Tento inhibítor TNF je určený na subkutánne podávanie, čo umožňuje pacientom s RA vyhnúť sa nákladným a zdĺhavým hospitalizáciám.
Etanercept sa používa na liečbu stredne ťažkej až stredne ťažkej reumatoidnej artritídy. vysoká aktivita zápalový proces. Liečivo má stimulačný účinok na receptory TNF-a prítomné v tele pacienta. Výsledkom je, že receptory aktívnejšie zachytávajú prebytok TNF-α, čím znižujú jeho koncentráciu, čo vedie k zníženiu zápalového procesu.
Podobne ako iné liečivá inhibítory TNF-α, aj etanercept sa výrazne líši farmakologické pôsobenie z imunosupresív používaných aj v niektorých režimoch liečby RA. Imunosupresíva ovplyvňujú takmer celý imunitný systém, zatiaľ čo inhibítory TNF-a sú aktívne proti špecifickým cieľom, ktoré sú špecifickými miestami v patogenéze reumatoidnej artritídy.
Výsledky štúdií etanerceptu ukázali, že nový liek- TNF inhibítor - vedie k výraznému zníženiu závažnosti symptómov ochorenia, dosiahnutiu perzistujúcich a dlhodobých remisií. Etanercept možno použiť ako monoterapiu RA (liečba týmto liekom samotným), tak aj ako súčasť komplexnej liečby. Inhibítory TNF možno kombinovať s nesteroidnými protizápalovými liekmi (NSAID), imunosupresívami (metotrexát), glukokortikoidmi (GC) a liekmi proti bolesti.
Etanercept sa podáva injekčne pod kožu. "Injekcie" sa vykonávajú dvakrát týždenne. Možné injekčné zóny: pod kožou ramena, prednej brušnej steny alebo stehna. Hospitalizácia pacientov na liečbu inhibítorom TNF nie je potrebná, môžu sa podávať injekcie zdravotná sestra v ošetrovni kliniky alebo doma.
Je potrebné poznamenať, že užívanie inhibítorov TNF môže byť sprevádzané určitými nežiaducimi účinkami: horúčka, hnačka, bolesť brucha, leukopénia (zníženie počtu leukocytov), bolesť hlavy, závraty, poruchy dýchania. Okrem toho sa v mieste vpichu niekedy vyskytujú lokálne reakcie ( pruritus a vyrážky).
Nebolo s určitosťou stanovené, aký účinok majú inhibítory TNF-α na ochrannú funkciu imunitného systému. Pacienti užívajúci etanercept majú byť preto upozornení, že užívanie lieku môže potenciálne vyvolať infekciu rôznymi infekciami. Etanercept sa nemá používať na liečbu pacientov s poruchou funkcie imunitný systém, pretože v tomto prípade sa u pacientov môže vyvinúť závažný stav infekčné choroby, ktoré sú plné sepsy a smrti. Etanercept je tiež kontraindikovaný u pacientov s určitými srdcovými ochoreniami (liek môže viesť k závažnému kardiovaskulárnemu zlyhaniu). Inhibítory TNF-α nie sú určené na liečbu RA bez účasti lekára.
Zavedenie inhibítorov TNF-α do širokej klinickej praxe možno považovať za jeden z najväčších pokrokov medicíny v liečbe RA za posledné desaťročia. Použitie tejto skupiny liekov umožňuje dosiahnuť remisiu ochorenia alebo výrazné zníženie aktivity zápalového procesu aj u pacientov, ktorí boli rezistentní (necitliví) na iné typy základnej antireumatickej terapie. Použitie inhibítorov TNF-α na liečbu RA výrazne spomaľuje progresiu deštrukcie (deštrukcie) postihnutých kĺbov, čo je potvrdené röntgenovými metódami.
Úvod. K dnešnému dňu je na liečbu reumatoidnej artritídy vhodných päť liekov blokujúcich tumor nekrotizujúci faktor (TNF): infliximab (infliximab), etanercept (etanercep), adalimumab (adalimumab), sortolizumab pegol (certolizumab pegol) a golimumab (golimumab).
Štúdia hodnotila účinnosť a bezpečnosť blokátorov TNF pri reumatoidnej artritíde (RA) a nepriamo porovnávala všetkých päť blokátorov kombináciou výsledkov randomizovaných klinických štúdií.
Materiály a metódy. Uskutočnil sa systematický prehľad literatúry o databázach: MEDLINE, SCOPUS (vrátane EMBASE), Cochrane Community Libraries a vyhľadávače o vedeckých materiáloch. Vybrali sa iba články o dvojito zaslepených, randomizovaných štúdiách blokátorov TNF oproti placebu, so súbežným metotrexátom alebo bez neho.
Zozbierané materiály obsahovali informácie o pacientoch a ich liečbe, kontrolných skupinách, výsledkoch, študijných metódach a možných zdrojoch zaujatosti. Kritériá zaradenia pacienta: vek najmenej 16 rokov a diagnostikovaná reumatoidná artritída podľa kritérií ACR (1987). Celkovo bolo spracovaných 6780 pacientov liečených blokátormi TNF a 3082 kontrolných pacientov. Metaanalýza získaných údajov bola vykonaná pomocou softvéru Cochrane Collaboration Review 5.0. Účinnosť a bezpečnosť blokátorov TNF sa analyzovala v šiestich rôznych základných porovnaniach.
Výsledky a závery. Do systematického prehľadu a metaanalýzy bolo zahrnutých celkovo 41 článkov z 26 randomizovaných klinických štúdií. Infliximab sa považovalo za 5 randomizovaných klinických štúdií, 7 – etanercept, 8 – adalimumab, po 3 – dolimumab a certolizumab.
Vo všetkých štúdiách vykazovali blokátory TNF vyššiu účinnosť ako placebo, ale mali porovnateľný účinok s metotrexátom. Golimumab bol menej účinný ako etanercept, adalimumab a certolizumab.Kombinácia blokátorov TNF a metotrexátu bola lepšia ako každá z nich samostatne. Zvyšovanie dávok nezlepšilo účinnosť. Blokátory TNF boli relatívne bezpečné a ich profil bol porovnateľný s metotrexátom.
U žiadneho z TNF blokátorov sa nepreukázala lepšia účinnosť v porovnaní s inými liekmi farmakologická skupina, ale výsledky štúdií bezpečnosti ukazujú, že etanercept je najbezpečnejším liekom. Je zaujímavé poznamenať, že metotrexát vykazoval takmer rovnaké výsledky účinnosti a bezpečnosti, napriek významnému rozdielu v nákladoch na tieto lieky.
Článok pripravil a upravil: chirurgVideo:
zdravé:
Súvisiace články:
- Poskytnúť živiny proliferujúcej synoviálnej membráne, tvorbe nových cievy- neoangiogenéza, ktorá...
- T bunky sa podieľajú na rozvoji reumatoidnej artritídy, pretože sú spojené s MHC triedy II a sú prítomné ...
- Poškodenie obličiek pri reumatoidnej artritíde sa prejavuje difúznou glomerulonefritídou, rozšírenou amyloidózou s primárnou léziou obličiek alebo ...
- Reumatoidná artritída (RA) má zvýšenú úmrtnosť, najmä v dôsledku kardiovaskulárnych ochorení a...
- Protilátky proti cyklickému citrulinovanému peptidu (ACCP) sú kľúčovým systémom autoprotilátok pri reumatoidnej artritíde. Citlivosť tohto...
- Štandardné laboratórne testy pri reumatoidnej artritíde v počiatočnom štádiu sú dôležité pre posúdenie závažnosti systémového zápalu ...
Pre citáciu: Nasonov E.L. Účinnosť a bezpečnosť inhibítorov tumor nekrotizujúceho faktora-a pri reumatoidnej artritíde // RMJ. 2008. Číslo 24. S. 1602
Reumatoidná artritída (RA) je najčastejším zápalovým ochorením kĺbov s prevalenciou asi 1 % v populácii a ekonomickými stratami pre spoločnosť sú porovnateľné s ischemickej choroby srdiečka. Štúdium RA má všeobecný medicínsky význam, pretože vytvára predpoklady pre rozlúštenie základných mechanizmov rozvoja a zlepšenie farmakoterapie iných bežných ľudských ochorení (ateroskleróza, cukrovka 2 typy, osteoporóza a pod.), patogeneticky spojená s chronickým zápalom.
Liečba RA zostáva jedným z najťažších problémov v klinickej medicíne. U mnohých pacientov ani včasné začatie mono- alebo kombinovanej liečby tradičnými DMARDs nie vždy spomalí progresiu kĺbovej deštrukcie, a to aj napriek pozitívnej dynamike klinických indikátorov aktivity zápalu. To všetko bolo vážnym podnetom na zlepšenie prístupov k farmakoterapii RA, založených na moderných medicínskych technológiách a dešifrovaní základných mechanizmov rozvoja reumatoidného zápalu.
Zvlášť dôležité v patogenéze RA a iných chronických zápalové ochoreniačlovek dostáva tumor nekrotizujúci faktor (TNF)-a - najviac preštudovaný zástupca skupiny takzvaných "prozápalových" cytokínov. TNF-a vykazuje početné „prozápalové“ účinky (obr. 1), ktoré majú zásadný význam v imunopatogenéze RA.
Pokrok biológie a medicíny na konci 20. storočia rozšíril možnosti farmakoterapie RA. Boli vyvinuté zásadne nové protizápalové lieky lieky(lieky), zjednotené pod všeobecným pojmom „biologické prípravky vyrobené genetickým inžinierstvom“ . Medzi ne patrí predovšetkým TNF-a inhibítory blokovanie biologická aktivita tohto cytokínu v obehu a ďalej bunkovej úrovni: chimérické (infliximab - IFN) a ľudské (adalimumab - ADA) monoklonálne protilátky proti TNF-a a etanerceptu (ETN) (obr. 2), ktoré sú považované za jedny z najúčinnejších liekov na liečbu RA.
ETN je hybridná molekula pozostávajúca z TNF receptora (P) s molekulovou hmotnosťou 75 kD, spojeného s Fc fragmentom Ig 1 človeka (obr. 2). Dimérna štruktúra FNOR v molekule ETN poskytuje vyššiu afinitu liečiva k TNF-a, čo zase určuje výraznejšiu kompetitívnu inhibíciu aktivity TNF-a v porovnaní s monomérnym rozpustným FNOR prítomným v biologických tekutinách. Prítomnosť fragmentu IgG v molekule ETH Fc prispieva k dlhšej životnosti liečiva v obehu ako monomérny FNOR. ETN kompetitívne inhibuje väzbu TNF-a a TNF-b (lymfotoxín-a) na membránový FNOR, čím ruší biologický účinok TNF, a jeho účinnosť bola preukázaná na rôznych experimentálnych modeloch zápalu, vrátane artritídy pripomínajúcej ľudskú RA.
Farmakokinetika ETN nezávisí od pohlavia a veku pacientov, nemení sa počas kombinovanej liečby s metotrexátom (MT). V prípade poškodenia obličiek alebo zlyhania pečene nie je potrebná titrácia dávky. klinicky významné liekové interakcie ETN s digoxínom a warfarínom sa nezaznamenal.
Vysoká účinnosť a prijateľná bezpečnosť ETN bola preukázaná v sérii randomizovaných placebom kontrolovaných štúdií (RPCT) a ich otvorenej fáze, v ich metaanalýze a v procese dlhodobého užívania lieku v reálnej klinickej praxi ( údaje z národných registrov). Uvažujme o najdôležitejších z nich.
Dôležité výsledky sa získali v štúdii TEMPO (Trial of Etanrecept and Methotrexate with radiological patient results), ktorá zahŕňala 682 pacientov s významnou RA (priemerné trvanie ochorenia 6 rokov). Prebieha otvorená fáza tejto štúdie a analýza získaných výsledkov. V kontrolovanej fáze štúdie boli pacienti randomizovaní do 3 skupín. Skupina 1 pozostávala z pacientov dostávajúcich monoterapiu ETN, skupina 2 - pacienti dostávajúci monoterapiu MT (do 20 mg týždenne), skupina 3 - pacienti dostávajúci kombinovanú liečbu ETN a MT. Zistilo sa, že účinnosť kombinovanej terapie (ACR, DAS, DAS28 a HAQ) a frekvencia remisie bola po 24, 52 a 100 týždňoch signifikantne vyššia ako pri monoterapii ETN aj MT. terapia (s<0,01 во всех случаях) . Комбинированная терапия более эффективно, чем монотерапия, тормозила деструкцию суставов. Частота побочных эффектов, включая инфекционные осложнения, в сравниваемых группах больных не отличалась.
Nedávno sme analyzovali výsledky 4-ročného sledovania pacientov, ktorí sa naďalej zúčastňovali na otvorenej fáze štúdie TEMPO, z ktorých 55 pacientov pridalo ETN k MTX, 76 pacientov pridalo MTX k ETN a 96 pokračovalo v kombinácii terapia ETN a MTX. Na začiatku mali pacienti liečení monoterapiou MT alebo ETN miernu aktivitu ochorenia, zatiaľ čo pacienti liečení kombinovanou terapiou mali nízku aktivitu ochorenia. Do konca 4. roku sa miera remisie u pacientov 1. skupiny zvýšila z 23,6 na 41,8 % (p<0,01), у пациентов группы 2 - с 26,7 до 36,8% (p>0,05) a u pacientov skupiny 3 - od 37,6 do 50% (p<0,01).
Tieto údaje presvedčivo poukazujú na vysokú účinnosť kombinovanej liečby ETN a MT počas dlhodobej liečby u pacientov s RA, ktorá pretrváva a dokonca sa zvyšuje do konca 4. roku kontinuálnej liečby. Navyše, keď MT nie je dostatočne účinná, pridanie ETN umožňuje dosiahnuť dobrý klinický efekt, čím sa z dlhodobého hľadiska rozširujú terapeutické možnosti farmakoterapie RA.
Hoci sa MTX považuje za „zlatý štandard“ liečby RA, mnohí pacienti pociťujú neadekvátnu liečbu, kontraindikácie liečby alebo vedľajšie účinky, ktoré si vyžadujú prerušenie liečby MTX. U niektorých pacientov môže byť dobrou alternatívou k MT sulfasalazín (SULF), ktorý je jedným z najúčinnejších DMARD. To slúžilo ako základ pre vykonanie RCT ( Štúdia o etanercepte 309 ), ktorá zahŕňala 254 pacientov randomizovaných (2:1:2) do 3 skupín: monoterapia SULF (n=50), monoterapia ETN (n=103) a kombinovaná liečba ETN a SULF (n=101). Kritériá zaradenia do štúdie boli vysoká aktivita ochorenia (≥6 bolestivé a opuchnuté kĺby, ranná stuhnutosť ≥45 minút, ESR≥28 mm/h, CRP≥20 mg/l) napriek liečbe SULF. Zistilo sa, že monoterapia ETN a kombinovaná terapia ETN a SULF sú signifikantne účinnejšie ako monoterapia SULF podľa kritérií ACR (p<0,01). При этом различия в эффективности ЭТН и СУЛЬФ были достоверны уже через 2 нед. после начала терапии (p<0,01). Значение индекса DAS28 к 24 нед. в группе пациентов, получавших СУЛЬФ, уменьшилось на 19,6%, в то время как в группе, получавшей монотерапию ЭТН - на 48,2%, а комбинированную терапию - на 49,7%. Положительная динамика имела место и в отношении параметров качества жизни (p<0,01), причем эти различия были достоверны уже через 2 нед. лечения. Частота побочных эффектов, таких как головная боль, тошнота астения, была несколько выше в группе больных, получавших комбинированную терапию (p<0,05), в то время как инфекционных осложнений и инъекционных реакций - у пациентов, получавших монотерапию ЭТН (p<0,05).
V otvorenej prospektívnej štúdii O`Dell J.R. a kol. hodnotili účinnosť kombinovanej liečby ETN s najčastejšie používanými DMARD, ako je SULF (n=50), hydroxychlorochín (n=50) a intramuskulárne soli zlata (n=19), u pacientov, u ktorých zlyhala monoterapia týmito liečivami. Vo všetkých skupinách pacientov došlo k významnému poklesu klinickej aktivity podľa kritérií ACR20, 50 a 70 (do 24. a 48. týždňa) bez významného rozdielu medzi skupinami. Vo všeobecnosti sa klinická odpoveď podľa ACR20 pozorovala do 24 týždňov. v 67 % a do 48 týždňov. - u 54 % pacientov. Výskyt nežiaducich účinkov bol podobný ako v iných štúdiách, miera prerušenia liečby z dôvodu nežiaducich účinkov bola 9 %.
Nepochybne zaujímavé sú údaje Finckh A. et al. ktorí vykonali podrobnú analýzu kohorty pacientov liečených inhibítormi TNF-a a inými DMARD (databáza Swiss Clinical Quality Management in Rheumatoid Arthritis). Do analýzy bolo zahrnutých celkovo 1 218 pacientov (z 2 097 zahrnutých v databáze), z ktorých 842 dostalo inhibítory TNF-α v kombinácii s MTX (31 % ETN), 260 v kombinácii s leflunomidom (32 % ETN) a 116 s inými DMARD (45 % ETN). Zároveň neboli medzi porovnávanými skupinami pacientov signifikantné rozdiely v dĺžke liečby, účinnosti (klinickej a rádiologickej) a frekvencii nežiaducich účinkov.
Tieto údaje naznačujú potenciál pre monoterapiu s ETN (keď nie je možné predpísať MTX) alebo kombinovanú liečbu s MTX a inými DMARD.
Vzhľadom na súčasnú koncepciu farmakoterapie RA spojenú s včasnou agresívnou liečbou DMARD, vrátane biologických látok, v kombinácii so starostlivým hodnotením účinnosti zameranej na dosiahnutie remisie, sú štúdie týkajúce sa použitia ETN pri včasnej RA mimoriadne zaujímavé (tabuľka 1).
Nedávno bola dokončená multicentrická medzinárodná štúdia COMET (Combination of metotrexate and etanercept), do ktorej boli zaradení pacienti (n = 542) so skorou (trvanie 3 mesiace – 2 roky) aktívnou aktivitou (DAS28> 3,2 a zvýšením ESR> 28 mm /hodina RA alebo CRP>20 mg/l), ktorí nedostali MTX. Zároveň 92 % pacientov malo vysokú aktivitu ochorenia (DAS28>5,1). Pacienti boli randomizovaní do 2 skupín. Prvá zahŕňala 274 pacientov, ktorí dostávali ETN (50 mg/týždeň) a MT, a druhá zahŕňala iba MT. V závislosti od účinku (počet bolestivých a opuchnutých kĺbov) sa dávka MT zvýšila na 20 mg/týždeň. do 8 týždňov, počnúc dávkou 7,5 mg/týždeň. Dĺžka liečby bola 52 týždňov. Získané výsledky sú zhrnuté v tabuľke 2. Ku koncu štúdie nastala remisia u 50 % pacientov, ktorí dostávali kombinovanú liečbu ETN a MTX a len u 28 % pacientov, ktorí dostávali monoterapiu MTX (p<0,0001), а низкая активность - соответственно у 64 и 41% пациентов (p<0,001). Хороший/умеренный ответ по критериям EULAR отмечен у 94% получавших комбинированную терапию и у 80% пациентов, получавших монотерапию (p<0,001). При этом различия в эффективности лечения были высокодостоверны в течение всего периода наблюдения, начиная со 2 нед. Важно, что среди получавших комбинированную терапию и имевших хороший/умеренный ответ по критериям ЕULAR к 12-й неделе, у 94% пациентов эффект сохранялся до 24 нед. При этом среди пациентов, не отвечающих на комбинированную терапию к 12-й нед., у 54% развился хороший/умеренный эффект (EULAR) к 24 нед., а у 27% - клиническая ремиссия. У пациентов с высокой активностью отсутствие рентгенологического прогрессирования имело место у 80% в группе комбинированной терапии и у 59% получавших монотерапию МТ (p<0,0001). Комбинированная терапия существенно превосходила монотерапию по влиянию на параметры качества жизни (HAQ)
Napriek tomu, že RA postihuje najčastejšie ľudí v strednom veku, 10 – 33 % pacientov s RA je starších ako 65 rokov. Údaje týkajúce sa účinnosti a bezpečnosti inhibítorov TNF-a u starších pacientov sú však obmedzené, keďže títo pacienti vo všeobecnosti nie sú zahrnutí do RCT. Fleischman R.M. a kol. retrospektívne analyzovali výsledky niekoľkých RCT a otvorených štúdií, ktoré zahŕňali 1 128 pacientov, 197 (17 %) z nich bolo starších ako 65 rokov. V porovnávaných skupinách neboli signifikantné rozdiely v účinnosti a toxicite ETG terapie. Po prvom roku terapie sa teda odpoveď ACR20 vyskytla u 69 % pacientov mladších ako 65 rokov a u 66 % pacientov starších ako 65 rokov, ACR50 – u 40 % pacientov v oboch skupinách a ACR70 – v r. 17 %. Frekvencia vedľajších účinkov bola podobná. teda účinnosť a znášanlivosť liečby ETN u starších pacientov bola počas 6 rokov sledovania veľmi dobrá .
V inej štúdii od tej istej skupiny autorov boli do analýzy zahrnutí aj pacienti zo štúdie TEMPO. Rovnako ako v predchádzajúcej analýze neboli žiadne rozdiely v účinnosti v závislosti od veku pacientov. Po 6 mesiacoch účinok podľa ACR20/50/70 bol 70 %, 45 %/15 % u pacientov starších ako 65 rokov a 65 %/39 %/1 % u pacientov mladších ako 65 rokov a po 72 mesiacoch. v uvedenom poradí 79 %/47 %/11 % a 73 %/53 %/29 %. Znášanlivosť liečby a frekvencia vedľajších účinkov u starších a mladých ľudí bola podobná.
Vzhľadom na údaje o vysokom výskyte komorbidít u pacientov s RA, ktoré môžu mať významný vplyv na prognózu, je nepochybný záujem o RPCT vedenú Weismanom M. H. a kol. . Táto štúdia (16 týždňov) konkrétne skúmala vplyv komorbidít na bezpečnosť liečby ETN. Štúdia zahŕňala 535 pacientov s aspoň jedným komorbidným ochorením (diabetes mellitus, CHOCHP, nedávny zápal pľúc alebo rekurentné infekcie). Zistilo sa, že v skupine liečenej ETN je u pacientov s diabetom (RR=1,34) a CHOCHP (RR=1,58) malý štatisticky nevýznamný nárast výskytu závažných nežiaducich účinkov (8,6 % vs 5,9 %). . Výskyt infekčných komplikácií bol podobný (43,4 na placebe oproti 39,8 % na ETN). Prítomnosť komorbidných ochorení teda významne neovplyvňuje bezpečnosť liečby ETN a nie je kontraindikáciou jej použitia.
Nedávno Klareskog L. a kol. analyzovali výsledky dlhodobého užívania ETN u pacientov, ktorí sa zúčastnili na štúdiách otvorenej fázy tohto lieku v Spojených štátoch a Európe. Celkovo analýza zahŕňala 2054 pacientov s včasnou a pokročilou RA, refraktérnych na DMARD (9763 pacientorokov), ktorí užívali ETN 3-10 rokov. Zistilo sa, že účinnosť ETN sa udržiava dlhodobo: ACR20 - 70-76% pacientov, ACR50 - 48-58% a ACR70 - 31-37%.
Taktika liečby
Podľa odporúčaní sa má ETN predpisovať v dávke 25 mg 2-krát týždenne, čo zaisťuje optimálne farmakokinetické vlastnosti lieku. Neskôr sa však ukázalo, že ETN možno užívať v dávke 50 mg raz týždenne. . Pri neúčinnosti ETN v štandardnej dávke zvýšenie dávky (50 mg 2-krát týždenne) nevedie k zvýšeniu účinku.
Z hľadiska optimalizácie terapie RA pomocou ETN (aj z pohľadu farmakoekonomických vyhliadok) štúdia Kavanaugha A. et al. , ktorá retrospektívne analyzovala údaje štúdie TEMPO s cieľom objasniť možné načasovanie vývoja účinku počas liečby ETN. Počas liečby ETN a MT dochádza podľa autorov k zvýšeniu počtu „respondentov“ na terapiu o 24 týždňov. v porovnaní s 12 týždňami: 37,5 % pacientov na ACR20, 46,8 % na ACR50 a 51,1 % na ACR70. Preto sa pri rozhodovaní o taktike liečby ETN neodporúča skôr ako po 24 týždňoch. terapiu.
S rozšírením používania inhibítorov TNF-a v klinickej praxi sa otázka taktiky liečby pacientov, ktorí „nereagujú“ na liečbu inhibítormi TNF-a, stáva čoraz aktuálnejšou. Materiály observačných štúdií a národné registre geneticky upravených biologických produktov naznačujú, že ak je INF neúčinný, prechod na ETN (prepnutie) umožňuje dosiahnuť klinický účinok u pacientov s primárnou a sekundárnou neefektívnosťou alebo zabrániť vzniku vedľajších účinkov u pacientov, ktorí majú dôvod na prerušenie liečby boli toxické reakcie.
Avšak podľa prospektívnej štúdie Finckha A. et al. je anti-B bunková terapia (rituximab) účinnejšia ako prechod na iný inhibítor TNF-a (vrátane ETN), najmä ak je to spôsobené neúčinnosťou. TNF-a inhibítory. Tieto údaje sú v dobrej zhode s RCT, ktoré poskytujú presvedčivý dôkaz vysokej účinnosti rituximabu u pacientov nereagujúcich na liečbu inhibítormi TNF-a. Na základe podrobnej analýzy všetkých dostupných dôkazov panel NICE v súčasnosti neodporúča zmenu inhibítorov TNF-a a uprednostňuje rituximab.
Vedľajšie účinky
Vo všeobecnosti je ETN dobre tolerovaná aj pri dlhodobom užívaní a frekvencia prerušenia liečby z dôvodu nežiaducich účinkov podľa RCT a otvorených štúdií sa nelíši od porovnávacích skupín, s výnimkou injekčných reakcií, ktoré sa počas ETN vyskytujú častejšie. liečbe. Zvyčajne sa vyskytujú v prvých mesiacoch liečby, trvajú 3-5 dní, ale zriedkavo spôsobujú prerušenie liečby. Je zrejmé, že ETN nespôsobuje infúzne reakcie, čo je výhodou tohto lieku v porovnaní s INF, ktorý sa podáva intravenózne.
Pri predpisovaní ETN v rozsahu dávok od 10 mg do 25 mg 2-krát týždenne nedošlo k zvýšeniu frekvencie nežiaducich účinkov. do 50 mg 1-krát týždenne. a trvanie liečby (do 9 rokov), čo je podobné ako u pacientov, ktorí užívali liek 1 rok.
Analýza výsledkov používania ETN a iných inhibítorov TNF-a v reálnej klinickej praxi však upozornila na problém zriedkavých vedľajších účinkov, z ktorých hlavnými sú zvýšenie rizika infekčných komplikácií vrátane tuberkulózy a oportúnne infekcie, zhubné novotvary (lymfómy), autoimunitné syndrómy, demyelinizačné ochorenia nervového systému, kongestívne srdcové zlyhanie a niektoré ďalšie. Sú považované za triedovo špecifické vedľajšie účinky všetkých inhibítorov TNF-a. Pozitívne účinky inhibítorov TNF-a však výrazne prevažujú nad nevýhodami terapie spojenou s toxicitou. Okrem toho ťažký priebeh RA, ktorý je indikáciou na vymenovanie inhibítorov TNF-a, je spojený s nepriaznivou životnou prognózou, a to aj v dôsledku zvýšeného rizika infekčných a kardiovaskulárnych komplikácií. Tradičné DMARD môžu tiež spôsobiť nežiaduce reakcie s vyššou frekvenciou a nežiaducimi účinkami ako inhibítory TNF-a.
Infekčné komplikácie
Analýza údajov z pozorovacích a poregistračných štúdií poukazuje na zvýšené riziko bakteriálnych infekcií počas liečby inhibítormi TNF-a (tabuľka 3), najmä počas prvých 6 mesiacov. liečbu týmito liekmi. Zároveň je podľa množstva štúdií riziko vzniku infekčných komplikácií pri liečbe INF vyššie ako pri ETN.
Z hľadiska bezpečnosti liečby inhibítormi TNF-a má klinický význam najmä rozvoj tuberkulózy, ktorý je primárne spojený s reaktiváciou latentnej tuberkulóznej infekcie. Zároveň sa zistilo, že riziko vzniku tuberkulóznej infekcie pri liečbe ETG je výrazne nižšie ako pri INF a ADA.
Napríklad podľa Britského biologického registra, ktorý zahŕňa 9 882 pacientov liečených inhibítormi TNF-a (5 265 pacientov – ETN, 3 569 pacientov – INF a 2 511 pacientov – ADA) a 2 883 pacientov liečených štandardnými DMARD, bola infekcia TBC diagnostikovaná v 29 pacientov (všetci dostávali inhibítory TNF-a). V porovnaní s ETN (RR = 1,0) bolo riziko vzniku tuberkulózy 2,84 pre INF a 3,53 pre ADA. Diseminovaná tuberkulóza sa vyvinula u 1 pacienta liečeného INF a 4 pacientov liečených ADA.
Podobné výsledky boli získané v multicentrickej prospektívnej 3-ročnej štúdii ( RATIO (pomer). ) uskutočnenej vo Francúzsku, podľa ktorej bol celkový výskyt tuberkulózy počas liečby inhibítormi TNF-a 39,3/100 000 pacientorokov, čo bolo výrazne viac ako v populácii – 8,7/100 000 pacientorokov. Zároveň počas liečby ETN bola miera infekcie len 6,6/100 000 pacientorokov, kým pri INF a ADA to bolo 71,5/100 000 pacientorokov. Predbežná analýza ukázala, že rizikové faktory pre TBC zahŕňali vek (RR=1,04), pobyt v endemických oblastiach (RR=7,2) a užívanie INF a ADA v porovnaní s ETN (RR=10,05; p=0,006 a RR=8,63; p= 0,02).
Predpokladá sa, že rozvoj tuberkulózy krátko po vymenovaní inhibítorov TNF-a je spojený s reaktiváciou latentnej infekcie a neskôr s primárnou infekciou mykobaktériami. Počas liečby INF sa tuberkulóza rozvinie skôr (v priemere po 12-32 týždňoch) ako ETN (v priemere po 18-79 týždňoch). V inej štúdii sa ukázalo, že u pacientov liečených INF sa 43 % prípadov tuberkulóznej infekcie vyvinulo počas prvých 90 dní liečby, zatiaľ čo iba 10 % pacientov liečených ETN.
Existuje len málo štúdií o účinku inhibítorov TNF-a na priebeh infekcie vírusom hepatitídy B a C. Predpokladá sa, že inhibítory TNF-a môžu na jednej strane spomaliť klírens vírusu hepatitídy B, ale na druhej strane potlačiť zápal pečene spôsobený vírusom hepatitídy C. Existujú dôkazy o priaznivom účinku ETN (v kombinácii s interferónom-a a ribavirínom) na priebeh infekcie vírusom hepatitídy C. Avšak u nosičov HCV liečených ETN (a inými inhibítormi TNF-a) by sa hladiny pečeňových enzýmov mali sledovať dôkladnejšie.
Demyelinizačné ochorenia
Súvislosť medzi liečbou inhibítormi TNF-a a rozvojom demyelinizačných ochorení nervového systému je vysoko pravdepodobná, aj keď nie je dôsledne dokázaná. Medzi 77 152 pacientmi liečenými ETN bolo identifikovaných 17 prípadov demyelinizačných ochorení, čo je 31 prípadov na 100 000 pacientorokov, pričom v bežnej populácii je výskyt tejto patológie 4-6 prípadov na 100 000 pacientorokov. . Preto sa neodporúča vymenovanie inhibítorov TNF-a u pacientov s demyelinizačnými ochoreniami v anamnéze.
Kardiovaskulárny systém
Vzhľadom na základnú úlohu TNF-a pri rozvoji srdcového zlyhania sa uskutočnili 2 RCT (štúdie RENAISSANCE a RECOVER) na vyhodnotenie účinnosti ETN pri tejto patológii. Obe štúdie ukázali mierny trend k zvýšenej úmrtnosti u pacientov liečených ETN. Pri zhrnutí výsledkov týchto štúdií (štúdia RENEWAL) však nebola zistená súvislosť medzi liečbou ETN, rizikom úmrtnosti a rozvojom dekompenzácie. Hoci teda nebola dokázaná úloha inhibítorov TNF (s výnimkou vysokodávkovaného IFN) pri vzniku srdcového zlyhania, u pacientov so srdcovým zlyhaním alebo poklesom ejekčnej frakcie ľavej komory sa odporúča predpisovať ETN s opatrne a vyhnúť sa predpisovaniu vysokých dávok inhibítorov TNF-α.
Ďalší aspekt tohto problému je spojený s vysokým rizikom rozvoja skorého aterosklerotického vaskulárneho ochorenia a súvisiacich komplikácií (infarkt myokardu a mŕtvica) pri RA. V tejto súvislosti je potrebné upozorniť na údaje, že na pozadí liečby inhibítormi TNF-a (vrátane ETN) dochádza k zníženiu rizika vzniku kardiovaskulárnych príhod, predovšetkým u pacientov, ktorí „reagujú“ na liečbu týmito liekmi. .
Hepatotoxicita
Riziko hepatotoxických reakcií počas liečby inhibítormi TNF-a je minimálne, pričom väčšina prípadov je opísaná na pozadí užívania INF. Podľa analýzy databázy CORDONA nebola medzi liečbou ETN a zvýšením pečeňových enzýmov žiadna súvislosť, pričom pri užívaní INF a ADA bolo zaznamenané 2,5-násobné zvýšenie rizika tejto komplikácie.
cytopénia
Vývoj cytopénie je extrémne zriedkavý, ale je základom pre sledovanie počtu leukocytov, najmä pri kombinovanej terapii s ETN a myelotoxickými liekmi.
Autoimunitné reakcie
Na pozadí liečby inhibítormi TNF-a sa pozoruje rozvoj autoimunitných sérologických reakcií (ANF, anti-DNA, protilátky proti kardiolipínu, nukleozómy a histón), veľmi zriedkavo syndrómy podobné lupusu. Vo všeobecnosti je výskyt autoimunitných reakcií významne pravdepodobnejší počas liečby INF ako pri liečbe ETN.
Zhubné novotvary
Údaje týkajúce sa rizika vzniku malígnych novotvarov (predovšetkým lymfómov) počas liečby inhibítormi TNF-a sú protichodné. Je to spôsobené viacerými okolnosťami. Po prvé, u pacientov s RA, ktorí sú indikovaní na vymenovanie inhibítorov TNF-a, existuje zvýšené riziko vzniku lymfómov. Po druhé, niektoré lieky používané v kombinácii s inhibítormi TNF-a na liečbu RA majú schopnosť zvyšovať riziko vzniku lymfómov.
Analýza údajov z pozorovacích štúdií naznačuje, že liečba inhibítormi TNF-a je spojená s malým zvýšením rizika melanómu a iných kožných malignít (RR = 2,2 a 1,5). O otázke predpisovania ETN u pacientov s rizikom vzniku malígnych novotvarov by sa preto malo rozhodnúť individuálne. Kombinovaná liečba s ETN a cyklofosfamidom sa neodporúča, pretože môže zvýšiť riziko vzniku nádoru.
Obrovská základňa dôkazov získaná v priebehu mnohých RCPI, otvorenej fázy týchto štúdií a národných registrov, teda naznačuje vysokú účinnosť a prijateľnú bezpečnosť ETN pri RA, čo diktuje potrebu skorej registrácie a širokého používania tohto lieku. v Rusku.



Literatúra
1. Nasonov E.L. Reumatoidná artritída ako všeobecný zdravotný problém. Terapeut. Archív 2004; 5:5-7
2. Sigidin Ya.A., Lukina G.V. Reumatoidná artritída. Moskva, ANKO, 2001, 328 strán
3. Nasonov E.L. VN Liečba reumatoidnej artritídy. Klinické usmernenia. Vydavateľstvo Almaz, Moskva, 2006, 118 strán
4. Brown AK, Quin MA, Karim Z, a kol. Prítomnosť významnej synovitídy u pacientov s reumatoidnou artritídou s remisiou indukovanou antireumatickým liekom modifikujúcim ochorenie: dôkazy zo zobrazovacej štúdie môžu vysvetliť štrukturálnu progresiu. Arthritis Rheum 2006; 54: 3761-3673
5. Ferinstein GS. Vyvíjajúci sa koncept reumatoidnej artritídy. Nature 2003; 423:356-360
6.Beayert R; Fiers W. Faktor nekrózy nádorov a lymfotoxín. In: Mire-Sluis AR, Thorpe R., editori. Cytokíny. 1. vyd. Londýn: Academic Pr; 1998.pp. 235-60.
7. Feldman M., Brennanová F., Maini R.N. Úloha cytokínov pri reumatoidnej artritíde. Annu. Rev. Immunol. 1996; 14:397-440.
8. Násonov EL. Farmakoterapia reumatoidnej artritídy v ére geneticky upravených biologických liekov. Terapeutický archív, 2007, 5, 5-8
9. Nasonov E.L. Farmakoterapia reumatoidnej artritídy - pohľad do 21. storočia. Wedge. medicína 2005; 6:8-12
10. Násonov EL. Liečba reumatoidnej artritídy: súčasný stav problému. RMJ 2006; 14 (8); 573-577
11. Kuek A, Hazleman BL, Ostor AJK. Imunitne sprostredkované zápalové ochorenia (IMID) a biologická liečba: medicínska revolúcia. Postgrad Med J 2007; 83:251-269
12. Nasonov E.L. Tumor nekrotizujúci faktor-a je novým cieľom protizápalovej liečby reumatoidnej artritídy. Wedge. Pharmacol. Therapy 2001;1:64-70
13. Nasonov E.L. Perspektívy farmakoterapie zápalových reumatických ochorení: monoklonálne protilátky proti tumor nekrotizujúcemu faktoru. RMJ, 2001, 9, 7-9.
14. Tracey D, Klareskog L, Sasso EH a kol. Mechanizmy účinku antagonistu faktora nekrózy nádorov: komplexný prehľad. Pharmacol Therapeut 2008; 117:244-279
15. Mohler KM, Torrance DS, Smith CA, a kol. Receptory solubilného tumor nekrotizujúceho faktora (TNF) sú účinnými terapeutickými činidlami pri letálnej endotoxémii a fungujú súčasne ako nosiče TNF aj antagonisty TNF. J Immunol. 1993;151:1548-61.
16. Dhillon S, Lyseng-Williamson KA, Scott LJ. etanercept. Prehľad jeho použitia pri liečbe reumatoidnej artritídy. Drugs 2007; 67:1211-1241.
17. Korth-Bradley JM, Rubin AS, Hanna RK, a kol. Farmakokinetika etanerceptu u zdravých dobrovoľníkov. Ann Pharmacother. 2000;34:161-4.
18. Moreland LW, Schiff MH, Baumgartner SW a kol. Liečba etanerceptom pri reumatoidnej artritíde. Randomizovaná, kontrolovaná štúdia. Ann Intern Med 1999;130:478-486
19. Weinblatt ME, Kremer JM, Bankhurst AD, a kol. Štúdia s etanerceptom, rekombinantným fúznym proteínom receptora nekrotizujúceho nádory: fc u pacientov s reumatoidnou artritídou, ktorí dostávali metotrexát. N Engl J Med. 1999; 340: 253-9.
20. Kremer JM, Weinblatt ME, Bankhurst AD a kol. Etanercept pridaný k základnej liečbe metotrexátom u pacientov s reumatoidnou artritídou, pokračujúce pozorovanie. Arthritis Rheum 2003; 48: 1493-1499
21. Moreland LW, Cohen SB, Baumgartner SW, a kol. Dlhodobá bezpečnosť a účinnosť etanerceptu u pacientov s reumatoidnou artritídou. J Rheumatol 2001; 28:1238-1244
22. Klareskog L, van der Heijde D, de Jager JP a kol. Terapeutický účinok kombinácie etanerceptu a metotrexátu v porovnaní s každou liečbou samostatne u pacientov s reumatoidnou artritídou: dvojito zaslepená randomizovaná kontrolovaná štúdia. Lancet. 2004;363:675-81.
23. van der Heijde D, Klareskog L, Rodrigiez-Valvelde V, et al. Porovnanie etanerceptu a metoptrexátu, samotných a kombinovaných, pri liečbe reumatoidnej artritídy. Dvojročné klinické a rádiografické výsledky štúdie TEMPO, dvojito zaslepenej, randomizovanej štúdie. Arthritis Rheum 2006; 54:1063-1074
24. van der Heijde D, Klareskog L, Landewe R, a kol. Remisia ochorenia a trvalé zastavenie rádiografickej progresie s kombináciou etanerceptu a metotrexátu u pacientov s reumatoidnou artritídou. Arthritis Rheum 2007; 56: 3928-3939
25. Landewe R, van der Heijde D, Klareskog L, et al. Prerušenie medzi zápalom a deštrukciou kĺbov po liečbe etanerceptom a metotrexátom pomocou rádiografického vyšetrenia a výsledkov pacientov. Arthritis Rheum 2006; 54: 3119-3125
26. van der Heijde D, Burmester G, Melo-Gomes J, a kol. Bezpečnosť a účinnosť pridania etanerceptu k metotrexátu alebo metotrexátu k etanerceptu u pacientov so stredne aktívnou reumatoidnou artritídou, ktorí boli predtým liečení monoterapiou. Ann Rheum Dis 2008; 67:182-188
27. Kameda H, Ueki Y, Saito K, a kol. Porovnanie účinnosti a bezpečnosti medzi kombinovanou terapiou etanerceptom (ETN) plus metotrexátom (MT) a monoterapiou ETN u japonských pacientov refraktérnych na MTX s reumatoidnou artritídou; 24-týždňové výsledky frpm štúdie JESMR. Ann Rheum Dis 2008; 67 (Suppl II): 184
28. Klareskog L., Gaubitz M., Rodriguez-Valverde V. a kol. Dlhodobá, otvorená štúdia bezpečnosti a účinnosti etanerceptu (Enbrel) u pacientov s reumatoidnou artritídou neliečených inými antireumatikami modifikujúcimi ochorenie. Ann Rheum Dis 2006; 65: 1578-1584
29. van Riel PLC, Taggat AJ, Sany J, et al. Účinnosť a bezpečnosť kombinácie etanerceptu a metotrexátu oproti samotnému etanerceptu u pacientov s reumatoidnou artritídou s nedostatočnou odpoveďou na metotrexát: štúdia ADORE. Ann Rheum Dis 2006; 65: 1478-1483
30. van Riel PLC, Freundlich B, MacPeek D, a kol. Výsledok hlásený pacientom v štúdii monoterapie etanerceptom oproti kombinovanej liečbe s etanerceptom a metotrexátom pri reumatoidnej artritíde: štúdia ADORE. Ann Rheum Dis 2008; 67:1104-1110
31. Combe B, Codreanu C, Fiocco U a kol. Etanercept a sulfasalazín, samotné a kombinované, u pacientov s aktívnou reumatoidnou artritídou napriek užívaniu sulfasalazínu: dvojito zaslepené porovnanie. Ann Rheum Dis 2006; 65:1357-1362.
32. O'Dell JR, Petersen K, Leff R, a kol. Etanercept v kombinácii so sulfasalazínom, hydroxychlorochínom alebo zlatom pri liečbe reumatoidnej artritídy. J Rheumatol 2006; 33:213-218.
33 Finckh A, Dehler S, Gabay C a kol. Účinnosť leflunomidu ako súbežnej liečby inhibítormi TNF pri reumatoidnej artritíde. Populačná štúdia. Ann Rheum Dis 2008; 29. januára online.
34. Ikeda K, Cox S, Emery P. Biologická terapia pri včasnej artritíde – preliečenie alebo cesta? Arthritis Res Therapy 2007; 9:211
35 Machold KP, Nell VPK, Stamm TA, Smolen JS. Tradičná terapia DMARD: je postačujúca: Arthritis Res Ther 2006; 8:21 na samotnom
36 Bathon JM, Martin RW, Fleischmann RM, et al. Porovnanie etanerceptu a metotrexátu u pacientov s včasnou reumatoidnou artritídou. N Engl J Med. 2000;343:1586-93.
37. Genovese MC, Bathon JM, Martin RW a kol. Etanercept verzus metotrexát u pacientov s včasnou reumatoidnou artritídou: dvojročný rádiografický a klinický výsledok. Arthritis Rheum 2002; 46; 1443-1450
38. Genovese MC, Bathon JM, Fleishmann RM a kol. Dlhodobá bezpečnosť, účinnosť a rádiografický výsledok liečby etanerceptom u pacientov s včasnou reumatoidnou artritídou. J Rheumatol 2005; 32:1223-1242
39. Weinblatt ME, Genovese MC, Moreland LW, a kol. Účinnosť a bezpečnosť viac ako 9-ročnej liečby etanerceptom (Enbrel) u pacientov v Severnej Amerike s včasnou a dlhotrvajúcou reumatoidnou artritídou. Amer Coll Rheum. Výročné stretnutie Sci 2006 11. – 15. novembra; Washington D.C. (abst)
40. Baumgartner SW, Fleischmann RM, Moreland LW a kol. Etanercept (Enbrel) u pacientov s reumatoidnou artritídou s nedávnym jednorazovým zlepšením zdravotného postihnutia v porovnaní s preukázaným ochorením. J Rheumatol 2004; 31: 1532-1557
41. Emery P, Breedveld F.C., Hall S, a kol. Porovnanie monoterapie metotrexátom s kombináciou metotrexátu a etanerceptu pri aktívnej včasnej, stredne ťažkej až ťažkej reumatoidnej artritíde (COMET): randomizovaná, dvojito zaslepená, paralelná štúdia liečby. Lancet 2008; 16. júla online.
42. Moots R, Kekow J, Sato R a kol. Hodnotenie včasnej liečby kombináciou etanerceptu a metotrexátu na funkčný stav u pacientov s aktívnou reumatoidnou artritídou: štúdia COMET. Ann Rheum Dis 2008; 67 (Suppl II):188
43. Breedveld F, Emery P, Ferraccioli G, et al. Klinická odpoveď a remisia v 12., 24. a 52. týždni s kombináciou etanerceptu a metotrexátu pri liečbe aktívnej reumatoidnej artritídy v štúdii COMET. Ann Rheum Dis 2008; 67 (Suppl II): 320
44. Anis A, Zhang W, Emery P a kol. Výsledok súvisiaci s prácou pri včasnej aktívnej reumatoidnej artritíde: výsledky štúdie COMET. Ann Rheum Dis 2008; 67 (Suppl II): 79
45. Fleishman RM, Baumgartner SW, Tindall EA a kol. Reakcia na etanercept (Enbrel) u starších pacientov s reumatoidnou artritídou: retrospektívna analýza výsledkov klinických štúdií. J Rheumatol 2003; 30:691-696.
46 Bathon JM, Fleischmann RM, van der Heijde DM, et al. Bezpečnosť a účinnosť liečby etanerceptom u starších pacientov s reumatoidnou artritídou. J Rheumatol 2006; 33:234-243.
47. Weisman MH, Paulus HE, Burch FX, a kol. Placebom kontrolovaná, randomizovaná, dvojito zaslepená štúdia hodnotiaca bezpečnosť etanerceptu u pacientov s reumatoidnou artritídou a sprievodnými komorbidnými ochoreniami. Reumatológia 2007; 46:1122-1125.
48. Baumgatner SW, Fleishman RM, Moreland LW a kol. Etanercept (Enbrel u pacientov s reumatoidnou artritídou so skorým nástupom oproti potvrdenej chorobe: zlepšenie invalidity. J Rheumat 2004; 31: 1532-1537
49. Keystone E, Freundlich B, Schiff M a kol. Pacienti so stredne závažnou reumatoidnou artritídou dosahujú lepšie stavy aktivity ochorenia pri liečbe etanerceptom ako pacienti so závažnou reumatoidnou artritídou. Ann Rheum Dis 2008; 67 (Suppl II): 186.
50. Klareskog L, Moreland LW, Cohen SB, a kol. Bezpečnosť a účinnosť viac ako 10-ročnej nepretržitej liečby etanerceptom u pacientov s reumatoidnou artritídou v Severnej Amerike a Európe. Ann Rheum Dis 2008; 67 (Suppl II): 175
51. Chen Y-F, Jobanputra P, Barton P a kol. Systémový prehľad účinnosti adalimumabu, etanerceptu a infliximabu na liečbu reumatoidnej artritídy u dospelých a ekonomickej efektívnosti ich nákladov. Helth Technol Assessment 2006; 10 (42)
52. Cartlehner G, Hansen RA, Jonas BL a kol. Porovnávacia účinnosť a bezpečnosť biologických liekov na liečbu reumatoidnej artritídy: systémový prehľad a metaanalýza. J Rheumatol 2006; 33: 2398-2408
53 Alonso-Ruiz A, Pijoan JI, Ansuategui E a kol. Lieky na nádorový nekrotický faktor alfa pri reumatoidnej artritíde: systémový prehľad a metaanalýza účinnosti a bezpečnosti. BMC muskuloskeletálne poruchy 2008; 9:52
54. Donahue KE a kol. Systémový prehľad: porovnávacia účinnosť a poškodenie liekov modifikujúcich ochorenie pri reumatoidnej artritíde. Ann Intern Med 2008; 148:124-131
55. Nixon R, Bansback N, Brennanová A. Účinnosť inhibície tumor nekrotizujúceho faktora alfa a interleukínu 1 u pacientov s reumatoidnou artritídou: metaanalýza a upravené nejednoznačné porovnania. Reumatológia 2007, online
56. Zink A, Strangfeld A, Schneider M, et al. Účinnosť inhibítorov faktora nekrózy nádorov pri reumatoidnej artritíde v pozorovacej kohortovej štúdii. Arthritis Rheum 2006; 54: 3399-3407
57. Hyrich KM, Symmons DPM, Watson KD a kol. Porovnanie odpovede na monoterapiu infliximabom alebo etanerceptom s odpoveďou na súbežnú liečbu metotrexátom alebo iným antireumatickým liekom modifikujúcim ochorenie u pacientov s reumatoidnou artritídou. Výsledky z BSBR. Arthritis Rheum 2006; 54: 1786-1794
58. Krisatensen LE, Saxne T, Geborek P. LUNDEX, nový index účinnosti liečiva v klinickej praxi. Výsledky päťročnej observačnej štúdie liečby infliximabom a etanerceptom medzi pacientmi s reumatoidnou artritídou v južnom Švédsku. Arthritis Rheum 2006; 54:600-606
59. Keystone EC, Schiff MH, Kremer JM, a kol. Podávanie 50 mg etanerceptu raz týždenne pacientom s aktívnou reumatoidnou artritídou: Výsledky multicentrickej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdie. Arthritis Rheum. 2005;50:353-63.
60 Weinblatt ME, Schiff MH, Ruderman EM, a kol. Účinnosť a bezpečnosť etanerceptu 50 mg dvakrát týždenne u pacientov s reumatoidnou artritídou, ktorí mali suboptimálnu odpoveď na etanercept 50 mg jedenkrát týždenne. Arthritis Rheum 2008; 58: 1921-1930.
61. Ariza-Ariza R, Navarro-Sarabia F, Hernandez-Cruz B, a kol. Eskalácia dávky anti-TNF-a látok u pacientov s reumatoidnou artritídou. Systémový prehľad. Reumatológia 2006
62 Kavanaugh A, Klareskog L, van der Heijde D, a kol. Zlepšenie klinickej odpovede medzi 12. a 24. týždňom u pacientov s reumatoidnou artritídou na liečbe etanerceptom s metotrexátom alebo bez neho. Ann Rheum Dis 5. júna 2008. online
63. Lutt JR, Deodhar A. Reumatoidná artritída. Stratégie v manažmente pacientov vykazujúcich nedostatočnú odpoveď na antagonistu TNFa. droga 2008; 68:591-606
64. Iannone F, Trotta F, Montecucco C, a kol. Etanercept si zachováva klinický prínos dosiahnutý infliximabom u pacientov s reumatoidnou artritídou, ktorí prerušili liečbu infliximabom z dôvodu vedľajšieho účinku. Ann Rheum Dis 2007; 66:249-252
65. Cohen G, Courvoiser N, Cohen JD a kol. Účinnosť prechodu z infliximabu na etanercept a naopak u pacientov s reumatoidnou artritídou. Clin Exp Rheumatol 2005; 23:795-800
66. Di Poi E, Perrin A, Morassi MP a kol. Prechod na etanercept u pacientov s reumatoidnou artritídou bez odpovede na infliximab. Clin Exp Rheumatol 2007; 25:85-87
67. Haraoui B, Keystone EC, Thorne JC, a kol. Klinický výsledok pacientov s reumatoidnou artritídou po prechode z infliximabu na etanercept. J Rheumatol 2004; 31:2356-2359
68. Cantini F, Niccoli L, Porciello G, a kol. Prechod z ingliximabu alebo adalimumabu na etanercept 500 mg/raz týždenne u rezistentných alebo intolerantných pacientov s reumatoidnou artritídou. Arthritis Rheum 2005; 52 (Suppl 9): S384 (abst)
69. Buch MH, Bingham SJ, Bejarano V, a kol. Liečba pacientov s reumatoidnou artritídou: výsledok zlyhania infliximabu pri prechode na etanercept. Arthritis Rheum 2007; 57:448-453
70. Koike T, Harigai M, Inokuma S, a kol. Bezpečnosť a účinnosť prechodu z infliximabu na etanercept u pacientov s reumatoidnou artritídou: výsledky rozsiahleho japonského sledovania po uvedení lieku na trh. Ann Rheum Dis 2008; 67: (Suppl II):181
71 Finckh A, Ciurea A, Brulhart L, a kol. U pacientov s reumatoidnou artritídou s nedostatočnou odpoveďou na činidlá protinádorového nekrotizujúceho faktora môže byť deplécia B-buniek účinnejšia ako prechod na alternatívne činidlo proti faktoru nekrózy nádorov. Arthritis Rheum 2007; 56: 1417-1423
72 Finckh A, Ciurea A, Brulhart L, a kol. Ktorá podskupina pacientov s reumatoidnou artritídou najviac profituje z prechodu tp rituximabu oproti alternatívnym anti-TNF látkam po predchádzajúcom zlyhaní na anti-TNF látky? Ann Rheum Dis 2008; 67 (Suppl II):
73. Cohen SB, Emery P, Greenwald MW a kol. Rituximab na teumatoidnú artritídu refraktérnu na liečbu protinádorovým nekrotizujúcim faktorom. Výsledky multicentrickej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdie fázy III hodnotiacej primárnu účinnosť a bezpečnosť po dvadsiatich štyroch týždňoch. Arthritis Rheum 2006; 54: 2793-2806
74. Reumatoidná artritída - adalimumab, etanercept a infliximab (sekvenčné použitie). http://www.nice.org.uk/guidance/index
75. Furst DE, Breedveld FC, Kalden JR, a kol. Aktualizované konsenzuálne vyhlásenie o biologických látkach na liečbu reumatických ochorení, 2007. Ann Rheum Dis 2007; 66 (Suppl III): iii2-iii22
76. Kameň JH. Inhibítory tumor nekrotizujúceho faktora alfa: prehľad nežiaducich účinkov. UpToDate 2008, 31. máj, verzia 16.2
77. Askling J, Dixon W. Bezpečnosť terapie protinádorovým nekrotickým faktorom pri reumatoidnej artritíde. Curr Opin Rheumatol 2008; 20:138-144
78. Solomon DH, Lunt M, Schneeweiss S. Riziko infekcie spojené s antagonistom faktora nekrózy nádorov. Dávať zmysel epidemiologickým dôkazom. Arthritis Rheum 2008; 58:919-928
79. Kozlov RS, Jakušin SB, Nasonov EL. Infekčné komplikácie liečby blokátormi tumor nekrotizujúceho faktora: varovaný je predpažený. Klinická mikrobiológia a antimikrobiálna chemoterapia, 2006, 8:314-324
80. Kim HA, Yoo CD, Baek HJ a kol. Infekcia Mycobacterium tuberculosis v populácii pacientov s reumatickým ochorením liečených kortikosteroidmi. Clin Exp Rheumatol 1998; 16:9-13.
81 Doran MF, Crowson CS, Pond GR, a kol. Frekvencia infekcie u pacientov s reumatoidnou artritídou v porovnaní s kontrolami: populačná štúdia. Arthritis Rheum 2002; 46:2287-2293.
82. Kroesen, S, Widmer, AF, Tyndall, A, Hasler, P. Závažné bakteriálne infekcie u pacientov s reumatoidnou artritídou pod anti-TNF-alfa terapiou. Reumatológia (Oxford) 2003; 42:617.
83. Crum, NF, Lederman, ER, Wallace, MR. Infekcie spojené s antagonistami tumor nekrotizujúceho faktora alfa. Medicína (Baltimore) 2005; 84:291.
84. Gomez-Reino, JJ, Carmona, L, Valverde, VR, a kol. Liečba reumatoidnej artritídy inhibítormi tumor nekrotizujúceho faktora môže predisponovať k významnému zvýšeniu rizika tuberkulózy: multicentrická správa aktívneho dohľadu. Arthritis Rheum 2003; 48:2122.
85. Listing, J, Strangfeld, A, Kary, S, a kol. Infekcie u pacientov s reumatoidnou artritídou sa liečia biologickými látkami. Arthritis Rheum 2005; 52:3403.
86. Curtis, JR, Patkar, N, Xie, A, a kol. Riziko závažných bakteriálnych infekcií u pacientov s reumatoidnou artritídou vystavených antagonistom faktora nekrózy nádorov alfa. Arthritis Rheum 2007; 56:1125.
87. Curtis, JR, Xi, J, Patkar, N, a kol. Liekovo špecifické a časovo závislé riziká bakteriálnej infekcie u pacientov s reumatoidnou artritídou, ktorí boli vystavení antagonistom tumor nekrotizujúceho faktora alfa. Arthritis Rheum 2007; 56:4226.
88. Dixon, WG, Watson, K, Lunt, M, a kol. Miera závažnej infekcie, vrátane miestne špecifickej a bakteriálnej intracelulárnej infekcie, u pacientov s reumatoidnou artritídou, ktorí dostávajú terapiu protinádorovým nekrotizujúcim faktorom: výsledky z registra Britskej spoločnosti pre reumatológiu biologických. Arthritis Rheum 2006; 54:2368.
89. Wolfe F, Caplan L, Michaud K. Liečba reumatoidnej artritídy a riziko hospitalizácie pre pneumóniu: asociácie s prednizónom, chorobu modifikujúcimi antireumatickými liekmi a terapiou protinádorovým nekrotickým faktorom. Arthritis Rheum 2006; 54:628-634
90 Askling J, Fored CM, Brandt L, a kol. Časovo závislé zvýšenie rizika hospitalizácie s infekciou u švédskych pacientov s RA liečených antagonistami TNF. Ann Rheum Dis 2007; 66:1339-1344.
91 Dixon WG, Symmons DP, Lunt M, a kol. Závažná infekcia po terapii protinádorovým nekrotizujúcim faktorom alfa u pacientov s reumatoidnou artritídou: poučenie z interpretácie údajov z pozorovacích štúdií. Arthritis Rheum 2007; 56:2896-2904.
92. Keane, J, Gershon, S, Wise, RP, a kol. Tuberkulóza spojená s infliximabom, činidlom neutralizujúcim faktor alfa nádorovej nekrózy. N Engl J Med 2001; 345:1098.
93. Brassard, P, Kezouh, A, Suissa, S. Antireumatické lieky a riziko tuberkulózy. Clin Infect Dis 2006; 43:717.
94. Wallis, RS, Broder, MS, Wong, JY, a kol. Granulomatózne infekčné ochorenia spojené s antagonistami faktora nekrózy nádorov. Clin Infect Dis 2004; 38:1261.
95 Wolfe F, Michaud K, Anderson J, Urbansky K. Infekcia tuberkulózy u pacientov s reumatoidnou artritídou a účinok liečby infliximabom. Arthritis Rheum 2004;50:372-9.
96 Dixon WG, Hyrich KL, Watson KD a kol. Liekovo špecifické riziko tuberkulózy u pacientov s reumatoidnou artritídou liečených anti-TNF terapiou: výsledky z biologického registra BSP (BSRBR). Ann Rheum Dis 2008; 67: (Supp II): 178
97 Askling J, Fored CM, Brandt L, a kol. Riziko a charakteristika prípadu tuberkulózy pri reumatoidnej artritíde spojenej s antagonistami faktora nekrózy nádorov vo Švédsku. Arthritis Rheum 2005;52(7):1986-92.
98 Tubach F, Salmon D, Ravaud P, a kol. Riziko tuberkulózy pri anti-TNF je vyššie pri monoklonálnych protilátkach ako pri solubilnom receptore. Výsledky francúzskeho 3-ročného prospektívneho pomerového pozorovania. Ann Rheum Dis 2008; 67: (Suppl II): 52
99. Guidotti, LG, Ishikawa, T, Hobbs, MV, a kol. Intracelulárna inaktivácia vírusu hepatitídy B cytotoxickými T lymfocytmi. Imunita 1996; 4:25.
100. Guidotti, LG, Ando, K, Hobbs, MV a kol. Cytotoxické T lymfocyty inhibujú génovú expresiu vírusu hepatitídy B necytolytickým mechanizmom u transgénnych myší. Proc Natl Acad Sci USA 1994; 91:3764.
101. Nelson, DR, Lim, HL, Marousis, CG, a kol. Aktivácia systému tumor nekrotizujúceho faktora alfa pri chronickej infekcii vírusom hepatitídy C. Dig Dis Sci 1997; 42:2487.
102. Ferri C, Ferraccioli G, Ferrari D a kol. Bezpečnosť liečby protinádorovým nekrotickým faktorom-a u pacientov s reumatoidnou artritídou a chronickou infekciou vírusom hepatitídy C. J Rheumatol 2008, 1. august online.
103. Marotte H., Fontanges E., Bailly F. a kol. Liečba etanerceptom počas troch mesiacov je bezpečná u pacientov s reumatologickými prejavmi spojenými s vírusom hepatitídy C. Reumatológia 2007; 46:97-99
104. Mohan, N, Edwards, ET, Cupps, TR, a kol. Demyelinizácia vyskytujúca sa počas terapie protinádorovým nekrotizujúcim faktorom alfa pri zápalovej artritíde. Arthritis Rheum 2001; 44:2862.
105. Nasonov E.L., Samsonov M.Yu. Nové aspekty patogenézy srdcového zlyhania: úloha tumor nekrotizujúceho faktora Srdcové zlyhanie, 2000; 1(4): 139-143
106. Mann, D, McMurray, J, Packer, M, a kol. Cielená anticytokínová terapia u pacientov s chronickým srdcovým zlyhaním: výsledky randomizovaného celosvetového hodnotenia etanerceptu (RENEWAL). Náklad 2004; 109:1594.
107. Anker, SD, Coats, AJ. Ako sa ZOBRAZIŤ z RENAISSANCE? Význam výsledkov RECOVER, RENAISSANCE, RENEWAL a ATTACH. Int J Cardiol 2002; 86:123.
108. Gabriel, SE. Inhibícia tumor nekrotizujúceho faktora: súčasť riešenia alebo súčasť problému srdcového zlyhania pri reumatoidnej artritíde?. Arthritis Rheum 2008; 58:637.
109. Nasonov E.L. Problém aterotrombózy v reumatológii. Bulletin Ruskej akadémie lekárskych vied, 2003; 7, 6-10
110. Nasonov E.L. Reumatoidná artritída - model aterotrombózy rakoviny prsníka 2005; 13:509-512
111. Jacobsson LTH, Turesson C, Culfe A, a kol. Liečba blokátormi tumor nekrotizujúceho faktora je spojená s nižším výskytom prvých kardiovaskulárnych príhod u pacientov s reumatoidnou artritídou. J Rheumatol 2005; 32:1213-1228
112. Jacobsson LTN, Turesson C, Nilsson J-A, a kol. Liečba blokátormi TNF a riziko úmrtnosti u pacientov s reumatoidnou artritídou. Ann Rheum Dis 2007; 66:670-675
113. Dixon WG, Watson KD, Lunt M, a kol. Zníženie výskytu infarktu myokardu u pacientov s reumatoidnou artritídou, ktorí reagujú na liečbu protinádorovým nekrotizujúcim faktorom a. Výsledky z registra Britskej spoločnosti pre reumatológiu biologických látok. Arthritis Rheum 2007; 56: 2905-2912
114. Furst DE, Sokolove J, Greenberg J, et al. Riziko zvýšeného pečeňového enzýmu (LFTS) s inhibítormi THF pri reumatoidnej artritíde: analýza u 6861 pacientov s 22552 návštevami. Ann Rheum Dis 2008; 67:52
115. Haraoui B, Keystone E. Muskuloskeletálne prejavy a autoimunitné ochorenia súvisiace s novými biologickými látkami. Curr Opin Rheumatol 2006; 18:96-100
116. Mongey A-B, Hess EV. Pohľad na drogy: autoimunitné účinky liekov – čo je nové? Nat Clin Pract Rheumatol 2008; 4: 136-144'
117. Georgescu, L, Quinn, GC, Schwartzman, S, Paget, SA. Lymfóm u pacientov s reumatoidnou artritídou: súvislosť s chorobným stavom alebo liečbou metotrexátom. Semin Arthritis Rheum 1997; 26:794.
118. Gridley, G, McLaughlin, JK, Ekbom, A, a kol. Výskyt rakoviny u pacientov s reumatoidnou artritídou. J Natl Cancer Inst 1993; 85:307.
119. Ebeo, CT, Girish, MR, Byrd, RP, a kol. Metotrexátom indukovaný pľúcny lymfóm. Chest 2003; 123:2150.
120. Wolfe, W, Michaud, K. Biologická liečba reumatoidnej artritídy a riziko malignity: Analýzy z veľkej observačnej štúdie v USA. Arthritis Rheum 2007; 56:2886.
121. Stone, JH, Holbrook, JT, Marriott, MA a kol. Solídne malignity medzi pacientmi v štúdii Wegener's Granulomatosis Etanercept Trial. Arthritis Rheum 2006; 54:1608.
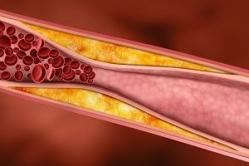
Tumor nekrotizujúci faktor alfa (TNF-ᵅ) je proteín so 157 aminokyselinami. Je to prvý multifunkčný cytokín rodiny TFN, ktorého vlastnosti boli identifikované na liečbu rakoviny. Jeho biologická aktivita je regulovaná TNF-alfa rozpustnými receptormi 1 a 2.
Prirodzený účinok je priamo vyjadrený stimuláciou produkcie interleukínu-1, ktorý je schopný rozpoznať zdravé a onkologické štruktúry na bunkovej úrovni. V tomto ohľade tumor nekrotizujúci faktor-alfa ovplyvňuje rakovinovú bunku cez jej povrch.
TNF-alfa v tele produkujú najmä aktívne makrofágy, T-lymfocyty a prirodzené zabíjačské bunky postihnutých tkanív. Hrá kľúčovú úlohu pri apoptóze a reprodukcii buniek.
Vplyv tohto prírodného prvku však úzko súvisí s toxicitou látky. Preto sa v súčasnosti používajú účinnejšie a menej toxické varianty tumor nekrotizujúceho faktora, napríklad Thymosin-alfa. Onkológovia tiež vyvíjajú spôsoby, ako priamo dodať nekrotický faktor do nádoru, bez ovplyvnenia iných tkanív a bez toho, aby boli zahrnuté do celkového obehu.
Nádorový nekrotický faktor alfa a rakovina
K dnešnému dňu vplyv tohto prvku, ako aj jeho antagonistov a následných biologických prvkov na také formy onkologických lézií, ako sú:
Zhubné nádory žalúdka a hrudníka:
Tumor nekrotizujúci faktor-alfa vedie k smrti potenciálne rakovinových buniek.
Nemalobunkový karcinóm pľúc:
TNF-alfa chráni telo pred účinkami rôznych patogénov, čo zabraňuje vzniku ochorenia.
Sarkóm a melanóm:
Pri týchto typoch rakoviny je rekombinantný obzvlášť účinný tumor nekrotizujúci faktor alfa.
Rakovina maternice a vaječníkov:
Tiež sú citlivé na tento prvok.
Nádorový nekrotizujúci faktor-alfa môže byť vďaka svojej schopnosti ničiť krvné zásobenie nádoru použitý aj na klinickú terapiu metastatického karcinómu.
Prípravky
Nádorový nekrotický faktor alfa súvisiace s cytokínmi. Sú schopné zabrániť nádorovej aktivite nielen pôsobením proti abnormálnym bunkám, ale aj kombináciou s hlavnými bunkovými mechanizmami. Preto sa pri výrobe liekov používajú tieto typy liekov, ktoré predstavujú inhibítory TNF:
- Monoklonálne protilátky ("Infliximab", adalimumab "Humira", rituximab, reprezentovaný liekom "Rituxan");
- Rekombinantné proteíny, ktoré zahŕňajú imunoglobulínové domény a TNF receptory, najmä interferón-1 a 2 (etanercept "Enbrel", golimumab "Simponi").
Medzi ruskými liekmi skupiny cytokínov vynikajú Refnot, Reaferon, Roferon, Intron a ďalšie.
cena
Náklady na lieky cytokinickej skupiny priamo závisia od krajiny výroby. Lieky európskeho a amerického pôvodu budú oveľa drahšie ako ruské a ukrajinské.
To však vôbec neznamená, že domáce liečivá sa budú líšiť od dovážaných z hľadiska špecifík ich pôsobenia. Takže napríklad nasmerujeme porovnávacie ceny za balenia drogy s rovnakou kapacitou 100 tisov. jednotka:
- prípravky obsahujúce monoklonálne protilátky (Rusko): 1 fľaša - od 1500 rubľov. až 2 000 rubľov; 5 fliaš - od 10 000 rubľov. až 12 000 rubľov;
- lieky s monoklonálnymi protilátkami (Ukrajina): 1 fľaša - od 500 UAH. až 800 UAH; za 5 fliaš je cena od 2000 UAH. až 3500 UAH;
- rekombinantné: cena v Rusku za jednu fľašu je od 2 000 rubľov. až 3000 rubľov. Na Ukrajine je cena vyššia: od 1000 UAH. až 1800 UAH čo je spojené s potrebou dopravy;
- cena dovážaných produktov obsahujúcich tumor nekrotizujúci faktor-alfa za liekovku sa pohybuje od 1000 USD. až 1300 USD
Kde kúpiť tumor nekrotizujúci faktor alfa?
Prípravky s obsahom tumor nekrotizujúceho faktora alfa je možné zakúpiť takmer vo všetkých krajinách sveta. V domácej farmakológii sa lieky skupiny cytokínov predávajú v lekárňach vo veľkých mestách. Ale vo väčšine prípadov sú lieky podávané pacientovi iba na lekársky predpis a predbežnú objednávku.
Pacienti z krajín SNŠ si môžu kúpiť liek od ruského výrobcu, pretože cena dovážaných liekov je mnohonásobne vyššia.
Potlačenie aktivity TNF vedie k zníženiu syntézy zápalových mediátorov v tele, vďaka čomu sa dosiahne potrebný terapeutický účinok pri liečbe ochorenia.
- si tu:
- Domov
- Správy
2018 Onkológia. Všetky materiály stránky sú zverejnené len na informačné účely a nemôžu byť základom pre prijímanie akýchkoľvek rozhodnutí o samoliečbe, vrátane. Všetky autorské práva na materiály patria ich príslušným vlastníkom
faktor nekrózy nádorov
Tumor nekrotizujúci faktor (TNF): stanovenie TNF; hodnota TNF; liečba anti-TNF liekmi; bezpečnosť návratnosti pre vyššiu efektivitu
- TNF je syntetizovaný aktivovanými makrofágmi a má cytotoxické, imunomodulačné a protizápalové účinky.
- TNF sa podieľa na antivírusovej, protinádorovej a transplantačnej imunite.
- Vo vzťahu k niektorým nádorom má TNF cytostatický a cytolytický účinok.
- TNF stimuluje makrofágy.
- Pri vysokých koncentráciách môže TNF poškodiť endotelové bunky a zvýšiť mikrovaskulárnu permeabilitu, čo spôsobí aktiváciu systému hemostázy a komplementu, po ktorej nasleduje akumulácia neutrofilov a intravaskulárna mikrotrombóza (DIC).
- Účinok TNF sa rozširuje na metabolizmus lipidov, koaguláciu, citlivosť na inzulín a zdravie endotelu, ako aj na množstvo ďalších funkcií.
- TNF inhibuje rast nádorových buniek a reguluje množstvo metabolických procesov, ako aj aktivitu imunitnej odpovede na infekčné agens, čo zabraňuje nekontrolovanému užívaniu anti-TNF liekov a vyvoláva otázky o ich bezpečnosti.
Aké sú mechanizmy protinádorového účinku TNF:
- TNF má cielený účinok na malígnu bunku prostredníctvom TNF receptorov, pričom vyvoláva programovanú bunkovú smrť alebo potláča proces delenia; tiež stimuluje produkciu antigénov v postihnutej bunke;
- stimuluje "hemoragickú" nekrózu nádoru (odumieranie rakovinových buniek).
- blokovanie angiogenézy - potlačenie procesu rastu nádorových ciev, poškodenie nádorových ciev bez poškodenia zdravých ciev.
Vlastnosti protinádorového účinku TNF:
- TNF nepôsobí na všetky nádorové bunky; Cytotoxicky rezistentné bunky samotné produkujú endogénny TNF a aktívny jadrový transkripčný faktor NF-kB.
- množstvo buniek vykazuje na dávke závislý účinok TNF, kombinované použitie cytokínov TNF a IFN-gama v mnohých prípadoch poskytuje oveľa výraznejší účinok ako pri liečbe jedným z týchto liečiv;
- TNF pôsobí na nádorové bunky, ktoré sú rezistentné na chemoterapiu a terapia založená na TNF v kombinácii s chemoterapiou môže postihnuté bunky účinne zabíjať.
- primárne a sekundárne imunodeficiencie;
- AIDS;
- závažné vírusové infekcie;
- ťažké popáleniny, zranenia;
- liečba cytostatikami, imunosupresívami, kortikosteroidmi.
- DIC;
- sepsa;
- infekčné choroby;
- alergické a autoimunitné ochorenia;
- kríza odmietnutia darcovských orgánov u príjemcov;
- onkologické ochorenia.
Prístroj - Microlab Star ELISA.
Norma: do 87 bal./ml
Referenčné hodnoty: 0 - 8,21 pg/ml.
- Sepsa (obsah môže mať fázovú povahu - zvýšenie na začiatku a zníženie s výraznou dlhotrvajúcou infekciou v dôsledku vyčerpania ochranných mechanizmov).
- Septický šok.
- DIC syndróm.
- Alergické ochorenia.
- Počiatočné obdobie u HIV-infikovaných.
- Obezita.
- V akútnom období rôznych infekcií.
- Závažné a pretrvávajúce vírusové infekcie.
- Onkologické ochorenia.
- AIDS.
- Stavy sekundárnej imunodeficiencie.
- Zranenia, popáleniny (ťažké).
- Myokarditída.
- Užívanie liekov: imunosupresíva, cytostatiká, kortikosteroidy.
Aké dôležité sú funkcie TNF v ľudskom tele?
Rozlišujú sa tieto mechanizmy vplyvu TNF:
- Cytotoxický účinok na nádorové bunky aj bunky ovplyvnené vírusmi.
- Stimuluje tvorbu ďalších účinných látok – leukotriénov, prostaglandínov, tromboxánu.
- Má imunomodulačný a protizápalový účinok (s aktiváciou makrofágov a neutrofilov).
- Zvýšená priepustnosť membrány.
- Zvýšená inzulínová rezistencia (účinok vedúci k rozvoju hyperglykémie, pravdepodobne v dôsledku inhibície aktivity inzulínového receptora tyrozínkinázy, ako aj stimulácie lipolýzy a zvýšenia koncentrácie voľných mastných kyselín).
- Poškodenie vaskulárneho endotelu a zvýšená priepustnosť kapilár.
- Aktivácia systému hemostázy.
- Hĺbková štúdia stavu imunity v prípade ťažkého priebehu akútnych, chronických, infekčných a autoimunitných ochorení.
- Onkológia.
- Ťažké mechanické poranenia a popáleniny.
- Aterosklerotické lézie ciev mozgu a srdca.
- Reumatoidná artritída a kolagenózy.
- Chronická patológia pľúc.
Zápalová aktivita CD4 T buniek
V podmienkach interakcie makrofágov so zápalovými T-bunkami sa pozoruje efektívnejšia fúzia fagozómov, ktoré zachytili baktérie, s lyzozómami, strážcami proteolytických enzýmov, ktoré ničia intracelulárne patogény. Proces fagocytózy je sprevádzaný takzvanou kyslíkovou explóziou - tvorbou kyslíkových radikálov a oxidu dusnatého, ktoré majú baktericídnu aktivitu.
Anti-TNF terapia by sa nemala predpisovať oslabeným pacientom, ako aj tým, ktorí predtým mali infekčné ochorenie, pretože. v oboch prípadoch sú vystavení vysokému riziku infekcie.
Recenzie
Chcel by som vidieť bibliografiu
Nepredstavia vám literatúru. Kontroverzný. Nie je dokázané. Experimenty.
Podstúpil som liečbu psoriázy s doktorom Ognevoyom, mimochodom, je dosť účinný. A teraz núti TNF vzdať sa!! Môže niekto vysvetliť, prečo a čo ukazuje na psoriázu. Hoci sadzba klesla. TNF dvakrát!! A pokožka je čistá
Kde si môžete kúpiť tento liek?
kde môžem kúpiť faktor nekrózy nádorov
HYBRIDNÝ POLYPEPTID S AKTIVITOU α1-TYMOSIN-α-NEKRÓZNY FAKTOR NÁDOROV-TYMOZÍN a1, METÓDA ZÍSKANIA HYBRIDNÉHO POLYPEPTIDU S AKTIVITOU α1-TYMOSÍN-α-TUMORSNEKROZUJÚCI FAKTOR DNA AHYBRID-THYBRID AESSING EXP1-THYBRID a ESSING POLYPEPTID S AKTIVITOU α1 - TYMOSÍN α FAKTOR NEKRÓZY NÁDOROV - THYMOSIN- a1 Patent Ruskej federácie
Prípravky proti TNF
Reumatológia je špecializácia vnútorného lekárstva zaoberajúca sa diagnostikou a liečbou reumatických ochorení.
Lieky, ktoré nie sú inhibítormi tumor nekrotizujúceho faktora (TNF), sú podľa klinickej štúdie publikovanej v Journal of the American Medical Association účinnejšie pri liečbe pacientov s reumatoidnou artritídou, ktorí nereagujú na anti-TNF lieky.
Anti-TNF lieky sa celosvetovo používajú na liečbu reumatoidnej artritídy. Deaktivujú TNF, molekuly produkované imunitným systémom, ktoré spôsobujú zápal. Približne tretina pacientov však na tento typ terapie nereaguje.
Štúdie sa zúčastnilo 300 pacientov s reumatoidnou artritídou, ktorí mali nedostatočnú odpoveď na anti-TNF lieky.
Všetci účastníci boli rozdelení do dvoch skupín. V prvej skupine pacienti dostávali lieky proti TNF ako adalimumab, etanercept, certolizumab a infliximab počas 52 týždňov. V druhej skupine pacienti užívali také non-TNF lieky ako tocilizumab, rituximab a abatasept.
Výsledky štúdie ukázali, že 54 % pacientov, ktorí užívali lieky proti TNF a 69 % účastníkov, ktorí užívali lieky bez TNF, malo miernu odpoveď na liečbu.
Okrem toho viac pacientov užívajúcich lieky bez TNF malo nízku úroveň aktivity ochorenia v 24. a 52. týždni štúdie.
Výskumníci dospeli k záveru, že pacienti s reumatoidnou artritídou, ktorí nereagovali na lieky proti TNF, môžu mať prospech z liekov, ktoré nie sú TNF.
Liečba liekmi proti TNF: vyplatí sa bezpečnosť za vyššiu účinnosť?
Tumor nekrotizujúci faktor (TNF) je extracelulárny proteín, zápalový cytokín so širokým spektrom účinku, ktorý je syntetizovaný najmä monocytmi a makrofágmi. Jeho pôsobenie sa rozširuje na metabolizmus lipidov, koaguláciu, citlivosť na inzulín a zdravie endotelu, ako aj na množstvo ďalších funkcií.
Prvýkrát bol TNF detegovaný v krvnom sére myší, ktorým bol injikovaný BCG a endotoxín. Ukázalo sa, že sérum takýchto myší má cytotoxický účinok a ďalšia štúdia odhalila proteín zodpovedný za vývoj tohto účinku.
V posledných rokoch sa dôležitosť TNF stáva čoraz dôležitejšou. Zvýšený záujem je spojený s obojsmerným pôsobením tohto cytokínu. Na jednej strane zohráva dôležitú úlohu pri regulácii normálnej diferenciácie, rastu a metabolizmu rôznych buniek a na druhej strane pôsobí ako mediátor patologických imunozápalových procesov pri rôznych ľudských ochoreniach.
Liečba polyartritídy
Polyartritída je typ artritídy, pri ktorej ochorenie postihuje viaceré kĺby. Postihuje ľudí všetkých pohlaví a veku a často sa spája s rôznymi autoimunitnými poruchami.
Liečba
Základná liečba polyartritídy (predpísaná reumatológom);
Symptomatická liečba (zameraná na úľavu od bolesti).
V druhom prípade sa používajú nesteroidné protizápalové lieky (v rôznych formách), napríklad brufen, indometacin-Acri, flugalin, ortofen, roxicam. Ale stojí za to zvážiť vedľajšie účinky, ako aj kontraindikácie užívania týchto liekov (napríklad peptický vred).
Lekárske ošetrenie
Nesteroidné protizápalové
NSAID pomáhajú znižovať zápal. Blokujú aktivitu prostaglandínov (látok, ktoré zohrávajú dôležitú úlohu pri zápaloch). Pomáhajú tiež zmierniť miernu až strednú bolesť. NSAID sú rýchlo pôsobiace a často majú menej vedľajších účinkov ako iné silnejšie a toxickejšie lieky používané na liečbu artritídy. V niektorých prípadoch môže užívanie týchto liekov spôsobiť tráviace ťažkosti, ako aj tvorbu vredov.
kortikosteroidy
Liečba polyartritídy týmito liekmi pomáha zmierniť zápal, ako aj potlačiť imunitnú odpoveď. Vzhľadom na skutočnosť, že polyartritída je často spôsobená autoimunitnými poruchami, ako je systémový lupus, tieto lieky sa používajú na potlačenie imunitnej odpovede, ktorá takéto poruchy sprevádza.
Vo väčšine prípadov sú to kortikosteroidy, ktoré sa ako prvé predpisujú pacientom s takýmito ochoreniami. Na prevenciu osteoporózy vyvolanej steroidmi sa odporúča užívať napríklad bisfosfonáty. Tieto lieky často zmierňujú bolesť a iné príznaky oveľa rýchlejšie ako iné lieky.
Základné antireumatiká (DMARDs)
PRP modifikujú priebeh ochorenia. Môžu zmeniť priebeh mnohých chorôb, ktoré spôsobujú polyartritídu. Vzhľadom na to, že začnú pôsobiť až 6-8 týždňov po začiatku podávania, počas tohto obdobia sa často predpisuje dodatočný súčasný príjem NSAID a kortikosteroidov. DMARDs, podobne ako kortikosteroidy, dosahujú svoj terapeutický účinok potlačením imunitného systému.
Polyartritída sa často lieči metotrexátom, rovnakým liekom, ktorý sa niekedy používa na chemoterapiu u pacientov s rakovinou (vo vysokých dávkach). Metotrexát niekedy spôsobuje poškodenie pečene, preto je pri jeho užívaní potrebné pacientovi pravidelne robiť rozbory krvi, aby sa tento, ako aj ďalšie možné vedľajšie účinky odhalili čo najskôr.
Nasledujúce DMARD sa tiež používajú na liečbu polyartritídy:
- Sulfasalazín.
- Hydroxychlorochín (liek proti malárii). V 1 prípade spôsobuje izon vážne poškodenie očí.
Lieky proti TNF
Pri mnohých typoch artritídy, vrátane polyartritídy, môže nádorový nekrotický faktor spôsobiť zápal. Lieky, ktoré blokujú faktor nekrózy nádorov, sa nazývajú lieky proti TNF.
Liečba polyartritídy si vyžaduje použitie nasledujúcich anti-TNF liekov:
Podávajú sa subkutánnou injekciou alebo intravenózne. Užívanie anti-TNF môže v niektorých prípadoch spôsobiť zimnicu, bolesti kĺbov a svalov, horúčku, zvýšenú náchylnosť na infekcie, bolesti hlavy a iné vedľajšie účinky.
Fyzioterapia
Fyzioterapia poskytuje príležitosť na zníženie bolesti, zápalu a opuchu. Táto liečba polyartritídy, ako je magnetoterapia, parafín, terapia ozokeritom, ultrazvuk, kryoterapia, sa používa súčasne s medikamentóznou terapiou. Umožňujú obnoviť prietok krvi do poškodených kĺbov, ako aj spomaliť proces úbytku kostnej hmoty a normalizovať metabolizmus.
Úplne odstrániť túto chorobu je nemožné. V tomto ohľade je liečba polyartritídy vždy nevyhnutná. Pomocou nepretržitej liečby bude pacient schopný dlhodobo udržiavať kvalitu svojho života, ako aj obvyklú úroveň aktivity a vynikajúcu pohodu.
Upozornenie: informácie zverejnené na stránke nie sú lekárskym odporúčaním, radou alebo návodom na konanie. Pred použitím informácií prezentovaných na našom portáli sa určite poraďte so svojím lekárom!
Faktor nekrózy nádorov - Alfa
Tumor nekrotizujúci faktor alfa (TNF-ᵅ) je proteín so 157 aminokyselinami. Je to prvý multifunkčný cytokín rodiny TFN, ktorého vlastnosti boli identifikované na liečbu rakoviny. Jeho biologická aktivita je regulovaná TNF-alfa rozpustnými receptormi 1 a 2.
Prirodzený účinok je priamo vyjadrený stimuláciou produkcie interleukínu-1, ktorý je schopný rozpoznať zdravé a onkologické štruktúry na bunkovej úrovni. V tomto ohľade tumor nekrotizujúci faktor-alfa ovplyvňuje rakovinovú bunku cez jej povrch.
TNF-alfa v tele produkujú najmä aktívne makrofágy, T-lymfocyty a prirodzené zabíjačské bunky postihnutých tkanív. Hrá kľúčovú úlohu pri apoptóze a reprodukcii buniek.
Vplyv tohto prírodného prvku však úzko súvisí s toxicitou látky. Preto sa v súčasnosti používajú účinnejšie a menej toxické varianty tumor nekrotizujúceho faktora, napríklad Thymosin-alfa. Onkológovia tiež vyvíjajú spôsoby, ako priamo dodať nekrotický faktor do nádoru, bez ovplyvnenia iných tkanív a bez toho, aby boli zahrnuté do celkového obehu.
Nádorový nekrotický faktor alfa a rakovina
K dnešnému dňu vplyv tohto prvku, ako aj jeho antagonistov a následných biologických prvkov na také formy onkologických lézií, ako sú:
Zhubné nádory žalúdka a hrudníka:
Tumor nekrotizujúci faktor-alfa vedie k smrti potenciálne rakovinových buniek.
Nemalobunkový karcinóm pľúc:
TNF-alfa chráni telo pred účinkami rôznych patogénov, čo zabraňuje vzniku ochorenia.
Sarkóm a melanóm:
Pri týchto typoch rakoviny je rekombinantný obzvlášť účinný tumor nekrotizujúci faktor alfa.
Rakovina maternice a vaječníkov:
Tiež sú citlivé na tento prvok.
Nádorový nekrotizujúci faktor-alfa môže byť vďaka svojej schopnosti ničiť krvné zásobenie nádoru použitý aj na klinickú terapiu metastatického karcinómu.
Prípravky
Tumor nekrotizujúci faktor alfa je cytokín. Sú schopné zabrániť nádorovej aktivite nielen pôsobením proti abnormálnym bunkám, ale aj kombináciou s hlavnými bunkovými mechanizmami. Preto sa pri výrobe liekov používajú tieto typy liekov, ktoré predstavujú inhibítory TNF:
- Monoklonálne protilátky ("Infliximab", adalimumab "Humira", rituximab, reprezentovaný liekom "Rituxan");
- Rekombinantné proteíny, ktoré zahŕňajú imunoglobulínové domény a TNF receptory, najmä interferón-1 a 2 (etanercept "Enbrel", golimumab "Simponi").
Medzi ruskými liekmi skupiny cytokínov vynikajú Refnot, Reaferon, Roferon, Intron a ďalšie.
Náklady na lieky cytokinickej skupiny priamo závisia od krajiny výroby. Lieky európskeho a amerického pôvodu budú oveľa drahšie ako ruské a ukrajinské.
To však vôbec neznamená, že domáce liečivá sa budú líšiť od dovážaných z hľadiska špecifík ich pôsobenia. Takže napríklad nasmerujeme porovnávacie ceny za balenia drogy s rovnakou kapacitou 100 tisov. jednotka:
- prípravky obsahujúce monoklonálne protilátky (Rusko): 1 fľaša - od 1500 rubľov. až 2 000 rubľov; 5 fliaš - otruby. dorub.;
- lieky s monoklonálnymi protilátkami (Ukrajina): 1 fľaša - od 500 UAH. až 800 UAH; za 5 fliaš je cena od 2000 UAH. až 3500 UAH;
- rekombinantný faktor nekrózy nádorov: cena v Rusku za jednu fľašu je od 2 000 rubľov. až 3000 rubľov. Na Ukrajine je cena vyššia: od 1000 UAH. až 1800 UAH čo je spojené s potrebou dopravy;
- cena dovážaných produktov obsahujúcich tumor nekrotizujúci faktor-alfa za liekovku sa pohybuje od 1000 USD. až 1300 USD
Kde kúpiť tumor nekrotizujúci faktor alfa?
Prípravky s obsahom tumor nekrotizujúceho faktora alfa je možné zakúpiť takmer vo všetkých krajinách sveta. V domácej farmakológii sa lieky skupiny cytokínov predávajú v lekárňach vo veľkých mestách. Ale vo väčšine prípadov sú lieky podávané pacientovi iba na lekársky predpis a predbežnú objednávku.
Pacienti z krajín SNŠ si môžu kúpiť liek od ruského výrobcu, pretože cena dovážaných liekov je mnohonásobne vyššia.
Recenzie
Na lieky z tejto skupiny sú rôzne názory nielen onkologických pacientov a ich príbuzných, ale aj samotných onkológov:
- Niektorí poukazujú na schopnosť liekov s tumor nekrotizujúcim faktorom-alfa samostatne bojovať proti rakovine.
- Ďalší odborníci potvrdzujú len schopnosť cytokínov zosilniť účinok tradičnej terapie.
- Dôraz na možné vedľajšie účinky, najmä u pacientov s latentnými vírusovými infekciami, tuberkulózou, kardiovaskulárnymi ochoreniami a chronickým ochorením pečene.
V každom prípade je maximálna dĺžka liečby tumor nekrotizujúcim faktorom alfa len 2 cykly. Môže sa vykonať doma po dôkladnej diagnostike a odbere testov.
Existuje len málo recenzií pacientov o lieku, ale väčšina pacientov s terapeutickým použitím tumor nekrotizujúceho faktora alfa zaznamenala zlepšenie ich celkového zdravotného stavu, najmä v prípade pokročilej alebo recidivujúcej rakoviny. Niektorí v neskorších štádiách vývoja ochorenia vnímajú liek ako jediný všeliek. Tento postoj však nie je adekvátny. Aj napriek pozitívnym hodnoteniam vo svetovej praxi stále prebieha výskum týkajúci sa bezpečnosti produktu.
Tumor nekrotizujúci faktor-alfa je jednou z najnovších biologických zbraní, o ktorej sa vo vedeckej onkológii stále veľa diskutuje.
Je dôležité vedieť:
Pridať komentár Zrušiť odpoveď
Kategórie:
Informácie na tejto stránke slúžia len na informačné účely! Neodporúča sa používať opísané metódy a recepty na liečbu rakoviny samostatne a bez konzultácie s lekárom!
Tumor nekrotizujúci faktor (TNF): úloha v organizme, stanovenie v krvi, podávanie vo forme liekov
Tumor nekrotizujúci faktor (TNF) je extracelulárny proteín, ktorý v krvi zdravého človeka prakticky chýba. Táto látka sa začína aktívne produkovať v patológii - zápal, autoimunizácia, nádory.
V modernej literatúre môžete nájsť jeho označenie ako TNF a TNF-alfa. Posledný názov sa považuje za zastaraný, no niektorí autori ho stále používajú. Okrem alfa-TNF existuje aj jeho ďalšia forma – beta, ktorú tvoria lymfocyty, no oveľa pomalšie ako tá prvá – niekoľko dní.
TNF je produkovaný krvnými bunkami – makrofágmi, monocytmi, lymfocytmi, ako aj endoteliálnou výstelkou krvných ciev. Keď sa cudzí antigénny proteín (mikroorganizmus, jeho toxín, produkty rastu nádorov) dostane do tela, TNF dosiahne maximálnu koncentráciu v priebehu prvých 2-3 hodín.
Nádorový nekrotický faktor nepoškodzuje zdravé bunky, má však silný protinádorový účinok. Prvýkrát bol takýto účinok tohto proteínu dokázaný v pokusoch na myšiach, u ktorých bola pozorovaná regresia nádorov. V tomto ohľade dostal proteín svoje meno. Neskoršie štúdie ukázali, že úloha TNF sa neobmedzuje len na lýzu nádorových buniek, jeho pôsobenie je mnohostranné, zúčastňuje sa nielen reakcií v patológii, ale je nevyhnutné aj pre zdravý organizmus. Všetky funkcie tohto proteínu a jeho pravá podstata zároveň stále vyvolávajú množstvo otázok.
Hlavnou úlohou TNF je účasť na zápalových a imunitných odpovediach. Tieto dva procesy spolu úzko súvisia a nemožno ich oddeliť. Vo všetkých štádiách tvorby imunitnej odpovede a zápalu pôsobí tumor nekrotizujúci faktor ako jeden z hlavných regulačných proteínov. V nádoroch sa aktívne vyskytujú aj zápalové a imunitné procesy „riadené“ cytokínmi.
Hlavné biologické účinky TNF sú:
- Účasť na imunitných reakciách;
- regulácia zápalu;
- Vplyv na proces hematopoézy;
- Cytotoxické pôsobenie;
- medzisystémový efekt.
Keď do tela vstupujú mikróby, vírusy, cudzie proteíny, aktivuje sa imunita. TNF podporuje zvýšenie počtu T- a B-lymfocytov, pohyb neutrofilov do miesta zápalu, „prilepenie“ neutrofilov, lymfocytov, makrofágov na vnútornú výstelku ciev v mieste zápalu. Výsledkom pôsobenia TNF je aj zvýšenie vaskulárnej permeability v oblasti rozvoja zápalovej odpovede.
Účinok tumor nekrotizujúceho faktora (TNF) na telesné bunky
Faktor nekrózy nádorov ovplyvňuje hematopoézu. Inhibuje reprodukciu erytrocytov, lymfocytov a bielych krviniek, ale ak je krvotvorba z akéhokoľvek dôvodu potlačená, potom ju TNF stimuluje. Mnohé aktívne proteíny, cytokíny, majú ochranný účinok proti žiareniu. Tento účinok má aj TNF.
Nádorový nekrotický faktor možno zistiť nielen v krvi, moči, ale aj v mozgovomiechovom moku, čo svedčí o jeho medzisystémovom účinku. Tento proteín reguluje činnosť nervového a endokrinného systému. Beta-typ TNF pôsobí prevažne lokálne a za systémové prejavy imunity, zápalu a regulácie metabolizmu organizmus vďačí práve alfa-forme cytokínu.
Jedným z najdôležitejších účinkov TNF je cytotoxický, teda deštrukcia buniek, ktorá sa naplno prejavuje pri vzniku nádorov. TNF pôsobí na nádorové bunky a spôsobuje ich smrť v dôsledku uvoľnenia voľných radikálov, reaktívnych foriem kyslíka a oxidu dusnatého. Keďže jednotlivé rakovinové bunky sa tvoria v každom organizme počas celého života, aj zdraví ľudia potrebujú TNF na svoju včasnú a rýchlu neutralizáciu.
Transplantácia orgánov a tkanív je sprevádzaná umiestnením cudzích antigénov do tela, aj keď je orgán najvhodnejší pre súbor špecifických individuálnych antigénov. Transplantáciu často sprevádza aktivácia lokálnych zápalových reakcií, ktoré sú tiež založené na pôsobení TNF. Akýkoľvek cudzí proteín stimuluje imunitnú odpoveď a transplantované tkanivá nie sú výnimkou.
Po transplantácii možno zistiť zvýšenie obsahu cytokínu v krvnom sére, čo môže nepriamo naznačovať nástup rejekčnej reakcie. Táto skutočnosť je základom výskumu používania liekov – protilátok proti TNF, ktoré dokážu spomaliť odvrhnutie transplantovaných tkanív.
Negatívny účinok vysokých koncentrácií TNF možno vysledovať v ťažkom šoku na pozadí septických stavov. Produkcia tohto cytokínu je obzvlášť výrazná počas infekcie baktériami, keď sa prudké potlačenie imunity kombinuje so zlyhaním srdca, obličiek a pečene, čo vedie k smrti pacientov.
TNF je schopný rozkladať tuk a deaktivovať enzým podieľajúci sa na akumulácii lipidov. Veľké koncentrácie cytokínu vedú k deplécii (kachexia), preto sa nazýval aj kachektín. Tieto procesy spôsobujú rakovinovú kachexiu a podvýživu u pacientov s dlhodobými infekčnými ochoreniami.
Okrem opísaných vlastností plní TNF aj reparačnú funkciu. Po poškodení v ohnisku zápalu a aktívnej imunitnej odpovedi sa procesy hojenia zvyšujú. TNF aktivuje systém zrážania krvi, vďaka čomu je zóna zápalu ohraničená pomocou mikrovaskulatúry. Mikrotromby zabraňujú ďalšiemu šíreniu infekcie. Aktivácia fibroblastových buniek a ich syntéza kolagénových vlákien prispieva k hojeniu lézie.
Stanovenie hladiny TNF a jeho význam
Laboratórna štúdia hladiny TNF sa nevzťahuje na často používané testy, ale tento indikátor je veľmi dôležitý pre určité typy patológie. Definícia TNF je uvedená, keď:
- Časté a dlhotrvajúce infekčné a zápalové procesy;
- autoimunitné ochorenia;
- zhubné nádory;
- horieť choroba;
- Zranenia;
- Kolagenóza, reumatoidná artritída.
Zvýšenie hladiny cytokínov môže slúžiť nielen ako diagnostické, ale aj ako prognostické kritérium. Takže pri sepse hrá prudký nárast TNF fatálnu úlohu, čo vedie k ťažkému šoku a smrti.
Na výskum sa pacientovi odoberá venózna krv, pred rozborom nie je dovolené piť čaj ani kávu, povolená je len čistá voda. Minimálne 8 hodín vopred by ste mali vylúčiť príjem akéhokoľvek jedla.
Zvýšenie TNF v krvi sa pozoruje pri:
- Infekčná patológia;
- sepsa;
- popáleniny;
- Alergické reakcie;
- Autoimunitné procesy;
- roztrúsená skleróza;
- Meningitída a encefalitída bakteriálnej alebo vírusovej povahy;
- DIC;
- reakcie štepu proti hostiteľovi;
- psoriáza;
- Diabetes mellitus prvého typu;
- Myelóm a iné nádory krvného systému;
- Šok.
Okrem zvýšenia je možné aj zníženie hladiny TNF, pretože normálne by mal byť prítomný, aj keď v malom množstve, na udržanie zdravia a imunity. Pokles koncentrácie TNF je typický pre:
- syndrómy imunodeficiencie;
- Rakovina vnútorných orgánov;
- Užívanie určitých liekov - cytostatiká, imunosupresíva, hormóny.
TNF vo farmakológii
Rozmanitosť biologických reakcií sprostredkovaných TNF podnietila výskum klinického použitia prípravkov faktora nekrózy nádorov a jeho inhibítorov. Najsľubnejšie sú protilátky, ktoré znižujú množstvo TNF pri ťažkých ochoreniach a zabraňujú smrteľným komplikáciám, ako aj rekombinantný syntetický cytokín predpisovaný pacientom s rakovinou.
Aktívne používané lieky analógy ľudského faktora nekrózy nádorov v onkológii. Napríklad takáto liečba spolu so štandardnou chemoterapiou vykazuje vysokú účinnosť proti rakovine prsníka a niektorým ďalším nádorom.
Inhibítory TNF-alfa majú protizápalové účinky. S rozvojom zápalu nie je potrebné okamžite predpisovať lieky tejto skupiny, pretože na zotavenie musí samotné telo prejsť všetkými štádiami zápalového procesu, vytvoriť imunitu a zabezpečiť hojenie.
Včasné potlačenie prirodzených obranných mechanizmov je spojené s komplikáciami, preto sú inhibítory TNF indikované až pri nadmernej, neadekvátnej reakcii, kedy organizmus nedokáže kontrolovať infekčný proces.
Inhibítory TNF - Remicade, Enbrel - sa predpisujú na reumatoidnú artritídu, Crohnovu chorobu u dospelých a detí, ulceróznu kolitídu, spondylartritídu, psoriázu. Tieto lieky sa spravidla nepoužívajú, ak je štandardná terapia hormónmi, cytostatikami, protinádorovými látkami neúčinná, ak je netolerovateľná alebo ak existujú kontraindikácie liekov iných skupín.
Protilátky proti TNF (infliximab, rituximab) potláčajú nadmernú tvorbu TNF a sú indikované pri sepse najmä s rizikom rozvoja šoku, pri pokročilom šoku znižujú mortalitu. Protilátky proti cytokínom možno predpísať v prípade dlhodobých infekčných ochorení s kachexiou.
Tymozín-alfa (timaktid) je klasifikovaný ako imunomodulačné činidlo. Predpisuje sa pri ochoreniach s oslabenou imunitou, infekčnou patológiou, sepsou, na normalizáciu krvotvorby po ožiarení, pri infekcii HIV a ťažkých pooperačných infekčných komplikáciách.
Cytokínová terapia je samostatný smer v liečbe onkopatológie, ktorý sa rozvíja od konca minulého storočia. Cytokínové prípravky vykazujú vysokú účinnosť, ale ich nezávislé použitie nie je opodstatnené. Najlepší výsledok je možný len s integrovaným prístupom a kombinovaným použitím cytokínov, chemoterapie a ožarovania.
Lieky na báze TNF ničia nádor, zabraňujú šíreniu metastáz a zabraňujú recidíve po odstránení nádorov. Pri súčasnom použití s cytostatikami cytokíny znižujú ich toxický účinok a pravdepodobnosť nežiaducich reakcií. Okrem toho cytokíny vďaka priaznivému účinku na imunitný systém zabraňujú možným infekčným komplikáciám počas chemoterapie.
Medzi liekmi TNF s protinádorovou aktivitou sa používajú refnot a ingaron, registrované v Rusku. Ide o lieky s preukázanou účinnosťou proti rakovinovým bunkám, ale ich toxicita je rádovo nižšia ako cytokín produkovaný v ľudskom tele.
Refnot má priamy deštruktívny účinok na rakovinové bunky, inhibuje ich delenie a spôsobuje hemoragickú nekrózu nádoru. Životaschopnosť novotvaru úzko súvisí s jeho zásobovaním krvou a refnot znižuje tvorbu nových ciev v nádore a aktivuje koagulačný systém.
Dôležitou vlastnosťou refnotu je jeho schopnosť zvyšovať cytotoxický účinok liekov na báze interferónu a iných protinádorových látok. Zvyšuje tak účinnosť cytarabínu, doxorubicínu a ďalších, vďaka čomu sa dosahuje vysoká protinádorová aktivita kombinovaného použitia cytokínov a chemoterapeutických liekov.
Refnot možno predpísať nielen na rakovinu prsníka, ako je uvedené v oficiálnych odporúčaniach na použitie, ale aj na iné novotvary - rakovina pľúc, melanóm, nádory ženského reprodukčného systému
Vedľajšie účinky pri použití cytokínov sú málo, zvyčajne krátkodobá horúčka, svrbenie kože. Lieky sú kontraindikované v prípade individuálnej neznášanlivosti, tehotných žien a dojčiacich matiek.
Cytokínovú terapiu predpisuje výlučne odborník, samoliečba v tomto prípade neprichádza do úvahy a lieky je možné zakúpiť len na lekársky predpis. Pre každého pacienta je vyvinutý individuálny liečebný režim a kombinácie s inými protinádorovými látkami.
Inhibítory tumor nekrotizujúceho faktora - moderné lieky na liečbu reumatoidnej artritídy
TNF-a (tumor nekrotizujúci faktor alfa) hrá kľúčovú úlohu pri spúšťaní a udržiavaní zápalového procesu pri reumatoidnej artritíde (RA). Potlačenie aktivity TNF vedie k zníženiu syntézy zápalových mediátorov v tele, vďaka čomu sa dosiahne potrebný terapeutický účinok pri liečbe ochorenia.
Jednou z nevýhod terapie inhibítormi TNF-a je vysoká cena. Tento spôsob liečby má však aj významné výhody: preukázaná účinnosť; bezpečnosť; pretrvávanie dosiahnutej remisie.
Uvažujme o použití inhibítorov TNF-α v klinickej praxi na príklade lieku s názvom etanercept, ktorý sa za posledných 10 rokov široko používa v USA, Kanade a európskych krajinách. Tento inhibítor TNF je určený na subkutánne podávanie, čo umožňuje pacientom s RA vyhnúť sa nákladným a zdĺhavým hospitalizáciám.
Etanercept sa používa na liečbu reumatoidnej artritídy so strednou až vysokou zápalovou aktivitou. Liečivo má stimulačný účinok na receptory TNF-a prítomné v tele pacienta. Výsledkom je, že receptory aktívnejšie zachytávajú prebytok TNF-α, čím znižujú jeho koncentráciu, čo vedie k zníženiu zápalového procesu.
Podobne ako iné inhibítory TNF-α, aj etanercept sa významne líši vo svojom farmakologickom účinku od imunosupresív, ktoré sa tiež používajú v niektorých režimoch liečby RA. Imunosupresíva ovplyvňujú takmer celý imunitný systém, zatiaľ čo inhibítory TNF-a sú aktívne proti špecifickým cieľom, ktoré sú špecifickými miestami v patogenéze reumatoidnej artritídy.
Výsledky štúdií etanerceptu ukázali, že nový liek, inhibítor TNF, vedie k výraznému zníženiu závažnosti symptómov ochorenia, k dosiahnutiu stabilných a dlhodobých remisií. Etanercept možno použiť ako monoterapiu RA (liečba týmto liekom samotným), tak aj ako súčasť komplexnej liečby. Inhibítory TNF možno kombinovať s nesteroidnými protizápalovými liekmi (NSAID), imunosupresívami (metotrexát), glukokortikoidmi (GC) a liekmi proti bolesti.
Etanercept sa podáva injekčne pod kožu. "Injekcie" sa vykonávajú dvakrát týždenne. Možné injekčné zóny: pod kožou ramena, prednej brušnej steny alebo stehna. Hospitalizácia pacientov na liečbu inhibítorom TNF nie je potrebná, injekcie môže podávať zdravotná sestra v ošetrovni polikliniky alebo doma.
Je potrebné poznamenať, že užívanie inhibítorov TNF môže byť sprevádzané určitými nežiaducimi účinkami: horúčka, hnačka, bolesť brucha, leukopénia (zníženie počtu leukocytov), bolesť hlavy, závraty, poruchy dýchania. Okrem toho sa v mieste vpichu niekedy vyskytujú lokálne reakcie (svrbenie kože a vyrážky).
Nebolo s určitosťou stanovené, aký účinok majú inhibítory TNF-α na ochrannú funkciu imunitného systému. Pacienti užívajúci etanercept majú byť preto upozornení, že užívanie lieku môže potenciálne vyvolať infekciu rôznymi infekciami. Etanercept sa nemá používať u pacientov s oslabeným imunitným systémom ako napr v tomto prípade sa u pacientov môžu vyvinúť závažné infekčné ochorenia, ktoré sú plné sepsy a smrti. Etanercept je tiež kontraindikovaný u pacientov s určitými srdcovými ochoreniami (liek môže viesť k závažnému kardiovaskulárnemu zlyhaniu). Inhibítory TNF-α nie sú určené na liečbu RA bez účasti lekára.
Zavedenie inhibítorov TNF-α do širokej klinickej praxe možno považovať za jeden z najväčších pokrokov medicíny v liečbe RA za posledné desaťročia. Použitie tejto skupiny liekov umožňuje dosiahnuť remisiu ochorenia alebo výrazné zníženie aktivity zápalového procesu aj u pacientov, ktorí boli rezistentní (necitliví) na iné typy základnej antireumatickej terapie. Použitie inhibítorov TNF-α na liečbu RA výrazne spomaľuje progresiu deštrukcie (deštrukcie) postihnutých kĺbov, čo je potvrdené röntgenovými metódami.
Informačný kanál Spinet.ru
- 08.02 Je možné nosiť vysoké opätky, ak máte problémy s chrbtom?
- 01.02 Ako vznikajú zlomeniny kostí u starších ľudí
- 27.01 Prínos alebo poškodenie z tréningu v zime
- 22.01 Kineziologický tejpovanie: mýty a realita
- 15.01 Aká strava je dobrá pre kosti
Najnovšie témy vo fóre:
Artritída
- Artritída
- Čo je artritída
- Príčiny
- Akútna purulentná artritída
- gonoreálna artritída
- Chlamýdiová artritída
- Artritída po očkovaní
- Traumatická artritída
- Profesionálna artritída
- Reuma
- Reaktívna artritída
- Artritída u detí
- Artralgia
- Artritída ramena
- Komplikácie artritídy
- DIAGNOSTIKA
- Diagnostika
- Diagnostické metódy
- Včasná diagnóza
- Laboratórna diagnostika
- Ťažkosti v diagnostike
- Metóda včasnej diagnostiky
- Úloha faktora nekrózy nádorov pri reumatoidnej artritíde
- Úloha T buniek pri rozvoji reumatoidnej artritídy
- LIEČBA
- Liečba reumatoidnej artritídy
- Diétna liečba
- Kryoterapia
- Peroxid vodíka
- Chondoprotektory
- Diétne jedlo
- Fyzioterapia
- Gymnastika pre kĺby
- Začnite liečbu čo najskôr
- Lieky
- Zmiernite bolesť doma
- Ako sa lieči artritída?
- Zabráňte deštrukcii kĺbov pri artritíde
- Kúpeľná liečba
- Ľudové metódy
- Liečba včelím jedom
- Použitie parafínu
- Aká je liečba artritídy?
- Alternatívna liečba artritídy
- Použitie (GCS) v terapii
- Úloha liekovej terapie
- Liečba dnavej artritídy
- Liečba ľudovými metódami
- Použitie doplnkov stravy v terapii
- Fytoterapia v liečbe artritídy
- Inhibítory tumor nekrotizujúceho faktora
- PREVENCIA
- Kĺby bolia
- Cvičenie na artritídu
- Aerobik
- diéta pri artritíde
zdravie chrbtice ©
Všetky informácie na stránke slúžia len na informačné účely. Tieto informácie nepoužívajte na samoliečbu. Možné kontraindikácie. Určite sa poraďte so svojím lekárom.